|
Органическая химия. Вопросы.
|
|
| Egor | Дата: Среда, 01.10.2014, 22:50 | Сообщение # 76 |
|
Группа: Пользователи
Сообщений: 267
| О, спасибо.
Возьмем для синтеза фумаровую кислоту и диен (как назвать его? 2-метилбутадиен-1,3 ? ).
Теперь самое сложное для меня. Как написать реакцию?
По теорию знаю, что рвутся две п-связи в исходных реагентах и одновременно образуются две δ-связи и одна п-связь.
Можете объяснить, как писать продукт?
|
|
| |
| |
| |
| Ефим | Дата: Среда, 01.10.2014, 23:30 | Сообщение # 77 |

Группа: Супермодераторы
Сообщений: 1839
| Цитата Egor (  ) Возьмем для синтеза фумаровую кислоту и диен (как назвать его? 2-метилбутадиен-1,3 ? ).
Так и назвать.
Цитата Egor (  ) Теперь самое сложное для меня. Как написать реакцию? По теорию знаю, что рвутся две п-связи в исходных реагентах и одновременно образуются две δ-связи и одна п-связь.
Можете объяснить, как писать продукт?
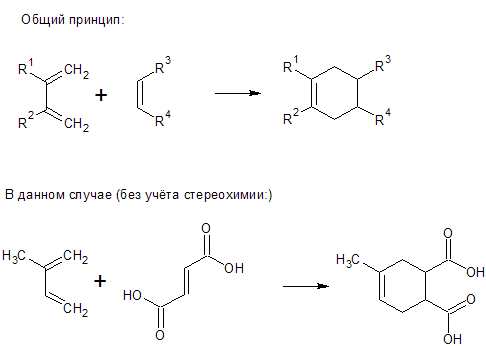
На картинке не показана конфигурация продуктов (там фактически два стереоизомера будет в виде рацемической смеси).
Да, и заместителей, конечно, может быть и больше четырёх. И диен и диенофил могут быть до упора замещёнными. Я уж не стал такие лохмушки рисовать, шоб яснее было 
Сообщение отредактировал Ефим - Среда, 01.10.2014, 23:33 |
|
| |
| |
| |
| Egor | Дата: Среда, 01.10.2014, 23:42 | Сообщение # 78 |
|
Группа: Пользователи
Сообщений: 267
| Вроде бы понял.
Из какого диена и диенофила образуется следующий аддукт.
Верно?
|
|
| |
| |
| |
| Ефим | Дата: Среда, 01.10.2014, 23:48 | Сообщение # 79 |

Группа: Супермодераторы
Сообщений: 1839
| Цитата Egor (  ) Верно?
Истинно! Пропаргиловый эфир и бутадиен.
|
|
| |
| |
| |
| Egor | Дата: Среда, 01.10.2014, 23:59 | Сообщение # 80 |
|
Группа: Пользователи
Сообщений: 267
| О, прекрасно.
Еще один маленький вопрос остался.
|
|
| |
| |
| |
| Egor | Дата: Четверг, 02.10.2014, 00:03 | Сообщение # 81 |
|
Группа: Пользователи
Сообщений: 267
| Верно?
|
|
| |
| |
| |
| Ефим | Дата: Четверг, 02.10.2014, 00:06 | Сообщение # 82 |

Группа: Супермодераторы
Сообщений: 1839
| Цитата Egor (  ) Верно?
Абсолютно!
|
|
| |
| |
| |
| Egor | Дата: Четверг, 02.10.2014, 00:23 | Сообщение # 83 |
|
Группа: Пользователи
Сообщений: 267
| Большое Вам спасибо!
|
|
| |
| |
| |
| Egor | Дата: Четверг, 02.10.2014, 23:33 | Сообщение # 84 |
|
Группа: Пользователи
Сообщений: 267
| Возник такой вопрос.
У нас есть циклопропан - С3Н6.
С3Н6 + Сl2 ---hv --->
С3Н6 + Br2 --->
Вопросы уже здесь.
В учебнике сказано
Цитата Фотохимическое хлорирование циклопропана возможно при температуре выше 100 0С или в присутствии кислот Льюиса сопровождает разрывом цикла с образованием 1,3-дихлорида. Но в более мягких условиях протекает реакция радикального замещения с сохранением цикла.
Цитата Бромирование на свету приводит к образованию 1,3-дибромидов.
А бромирование? Света же нет.. Дибромид-таки будет?
С3Н6 + H2 --Ni/800C--> пропан
С3Н6 + HBr ---H2O--->
Цитата Газообразные галогенводороды с циклопропаном не реагирует.
С3Н6 + H2SO4 (конц) ---00С--->
Какая здесь имеется в виду реакция?
Цитата Какие из этих реакция можно осуществить для циклобутана в аналогичных или более жестких условиях?
Циклобутан, как более устойчивый из малых циклов, не вступает в реакции электрофильного присоединения галогенов и галогенводородов.
Значит, его можно только прогидрировать? Только при высокой температуре.
Цитата Чем объясняет высокое значение теплоты сгорания циклопропана по сравнению с пропаном и одинаковую теплоту сгорания циклогексана и гексана? |
|
| |
| |
| |
| Ефим | Дата: Пятница, 03.10.2014, 14:46 | Сообщение # 85 |

Группа: Супермодераторы
Сообщений: 1839
| Цитата Egor (  ) У нас есть циклопропан - С3Н6. С3Н6 + Сl2 ---hv --->
С3Н6 + Br2 --->
Вопросы уже здесь.
В учебнике сказано
Цитата
Фотохимическое хлорирование циклопропана возможно при температуре выше 100 0С или в присутствии кислот Льюиса сопровождает разрывом цикла с образованием 1,3-дихлорида. Но в более мягких условиях протекает реакция радикального замещения с сохранением цикла.
Цитата
Бромирование на свету приводит к образованию 1,3-дибромидов.
Получается, что в нашем примере при хлорировании цикл сохранится, образуется хлорциклопропан.
А бромирование? Света же нет.. Дибромид-таки будет?
При радикальном бромировании циклопропана всегда получится дибромпропан (как и при электрофильном, в присутствии кислот Льюиса).
Цитата Egor (  ) С3Н6 + H2 --Ni/800C--> пропан С3Н6 + HBr ---H2O--->
Цитата
Газообразные галогенводороды с циклопропаном не реагирует.
Получается, что реакции никакой не будет. Так?
Газообразные не реагируют, но в условиях реакции упомянута вода, а это уже создаёт условия для электрофильной атаки с образованием бромпропана.
Цитата Egor (  ) С3Н6 + H2SO4 (конц) ---00С---> Какая здесь имеется в виду реакция?
Аналогичная присоединению галогенводородных кислот - образуется н-пропилсерная кислота.
Цитата Egor (  ) Циклобутан, как более устойчивый из малых циклов, не вступает в реакции электрофильного присоединения галогенов и галогенводородов. Значит, его можно только прогидрировать? Только при высокой температуре.
Да.
Цитата Egor (  ) ЦитатаЧем объясняет высокое значение теплоты сгорания циклопропана по сравнению с пропаном и одинаковую теплоту сгорания циклогексана и гексана?
Вот тут у меня идей что-то совсем нет. Подскажите, пожалуйста.
Причина та же, что и у более высокой реакционной способности - напряжение в малом цикле. Энергия напряжения и становится "добавкой" к теплоте сгорания.
|
|
| |
| |
| |
| Egor | Дата: Пятница, 03.10.2014, 21:47 | Сообщение # 86 |
|
Группа: Пользователи
Сообщений: 267
| Все понял. Спасибо большое!
Что образуется в результате реакции
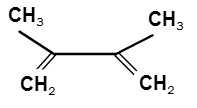
a) с Br2, LiCl при 50 0С .
СH2=C(CH3)-C(CH3)=CH2 + Br2 ---LiCl---> Br-CH2-C(CH3)=C(CH3)-CH2-Br + Br-CH2-C(CH3)=C(CH3)-CH2-Cl
b) Br2, H2O, -20 0C
СH2=C(CH3)-C(CH3)=CH2 + Br2 ----> Br-CH2-C(CH3)(Br)-C(CH3)=CH2
Верно? При разной температуре будет преобладание разных продуктов.
Все? Подвоха нет никакого?
|
|
| |
| |
| |
| Ефим | Дата: Пятница, 03.10.2014, 22:19 | Сообщение # 87 |

Группа: Супермодераторы
Сообщений: 1839
| Цитата Egor (  ) a) с Br2, LiCl при 50 0С . СH2=C(CH3)-C(CH3)=CH2 + Br2 ---LiCl---> Br-CH2-C(CH3)=C(CH3)-CH2-Br + Br-CH2-C(CH3)=C(CH3)-CH2-Cl
Тут я бы один продукт нарисовал - который бромхлор. Такую реакцию ведут в избытке конц. спиртового раствора хлористого лития, и дибромид получается в минимальном количестве.
Цитата Egor (  ) b) Br2, H2O, -20 0C СH2=C(CH3)-C(CH3)=CH2 + Br2 ----> Br-CH2-C(CH3)(Br)-C(CH3)=CH2
А вот в реакции олефинов с бромной водой получаются в основном бромгидрины. В данном случае - Br-CH2-C(CH3)(OH)-C(CH3)=CH2
В школьных учебниках этот факт часто игнорируют, но, тем не менее, это так.
|
|
| |
| |
| |
| Egor | Дата: Пятница, 03.10.2014, 23:06 | Сообщение # 88 |
|
Группа: Пользователи
Сообщений: 267
| Спасибо!
Есть соединения, нужно расположить их в ряд по скорости мононитрования (монобромирования).
Быстрее всего будет реагировать этилбензол.
Потом Ph-CH2-CCl3
Далее Ph-CH2-CF3
Медленнее всего Ph-CF2CH3.
Цитата Укажите способ генерирования электрофила.
HNO3 + 2H2SO4 <---> NO2+ + H3O+ + 2HSO4-
Нитроний-катион и будет электрофилом.
Так ведь?
Цитата Объясните направление протекания реакции электрофильного замещения для этих субстратов.
Дальше идут замещенные алкильные радикалы. Все галогены имеют +I-эффект, значит, чем ближе радикал к кольцу, тем больше он оттягивает на себя электронную плотность СН-связей, а это приводит к тому, что бензольное кольцо "слабо активируется" активируется. Так ведь?
Все равно же у нас здесь "рулят" алкильные радикалы, которую будут направлять замещение в о- и п-положение.
Да?
|
|
| |
| |
| |
| Ефим | Дата: Пятница, 03.10.2014, 23:46 | Сообщение # 89 |

Группа: Супермодераторы
Сообщений: 1839
| Цитата Egor (  ) Есть соединения, нужно расположить их в ряд по скорости мононитрования (монобромирования). Быстрее всего будет реагировать этилбензол.
Потом Ph-CH2-CCl3
Далее Ph-CH2-CF3
Медленнее всего Ph-CF2CH3.
Верно. Ориентирующее действие метила обусловлено индуктивным эффектом и гиперконьюгацией. Индуктивный эффект в этом ряду уменьшается, а в последнем случае и гиперконьюгация отсутствует.
Цитата Egor (  ) ЦитатаУкажите способ генерирования электрофила.
Имеется в виду
HNO3 + 2H2SO4 <---> NO2+ + H3O+ + 2HSO4-
Нитроний-катион и будет электрофилом.
Так ведь?
Так. Классическое описание механизма нитрования предполагает нитроний-катион в качестве электррофила.
Цитата Egor (  ) Объясните направление протекания реакции электрофильного замещения для этих субстратов.Возьмем этилбензол. Алкильные радикалы - ориентанты первого рода. Активируют о- и п-положение. Туда и пойдет замещение.
Дальше идут замещенные алкильные радикалы. Все галогены имеют +I-эффект, значит, чем ближе радикал к кольцу, тем больше он оттягивает на себя электронную плотность СН-связей, а это приводит к тому, что бензольное кольцо "слабо активируется" активируется. Так ведь?
Все равно же у нас здесь "рулят" алкильные радикалы, которую будут направлять замещение в о- и п-положение.
Да?
Галогены имеют -I эффект (и +М ). Я тоже часто путаю эти знаки 
Вы ссылаетесь на тот факт, что ориентанты первого рода всегда "рулят" при замещении. Но в данном случае мы имеем не просто алкильные радикалы. Например, возьмём ряд -CH3, -CH2Cl, -CHCl2, -CCl3. Первый (метил) - орто-пара-ориентант, хлорметильная группа уже не проявляет чётких ориентирующих свойств, дихлорметил - преимущественно мета-ориентант, а трихлорметил - чистый мета-ориентант.
Из общих соображений нельзя сказать, будут ли группы -CH2-CCl3 и -CH2-CF3 мета-ориентантами, но, то, что их ориентирующее действие в этом ряду будет смещаться от орто-пара к мета - это факт. Последняя группа (-CF2-CH3) - очевидно, будет уже мета-ориентантом.
В общем, можно утверждать наверняка, что в этом ряду (-CH2-CH3, -CH2-CCl3, -CH2-CF3, -CF2-CH3) ориентирующее действие будет смещаться от орто-пара к мета.
Это вопрос, кстати - принципиальный. Ориентация замещения - это не закон, это тенденция. Между "чистыми" заместителями I-ого и II-ого рода есть масса переходных вариантов, в том числе и заместители, которым вообще пофиг - куда там идёт замещение 
|
|
| |
| |
| |
| Egor | Дата: Суббота, 04.10.2014, 23:03 | Сообщение # 90 |
|
Группа: Пользователи
Сообщений: 267
| Я все понял.
Большое спасибо!
|
|
| |
| |
| |