|
Вопросы по неорганической химии
|
|
| Egor | Дата: Среда, 09.04.2014, 22:44 | Сообщение # 751 |
|
Группа: Пользователи
Сообщений: 267
| Спасибо большое!
|
|
| |
| |
| |
| Egor | Дата: Четверг, 10.04.2014, 21:27 | Сообщение # 752 |
|
Группа: Пользователи
Сообщений: 267
|  В учебнике прочитал следующее. В учебнике прочитал следующее.
Если у нас идет реакция, то какая формулу использовать?
Zn2+ + 4NH3 = [Zn(NH3)4]2+
Был простой цинк, отдал два электрона, стал Zn2+. Шел процесс окисления. Получается, что Zn2+ - это окисленная форма, верно?
Сообщение отредактировал Egor - Четверг, 10.04.2014, 21:28 |
|
| |
| |
| |
| FilIgor | Дата: Четверг, 10.04.2014, 21:34 | Сообщение # 753 |
 Эксперт
Группа: Супермодераторы
Сообщений: 6490
| Цитата Egor (  ) Если у нас идет реакция, то какая формулу использовать? Zn2+ + 4NH3 = [Zn(NH3)4]2+
Ну вообще-то, в этой реакции цинк не был простой, и никаких электронов не отдавал.
|
|
|
It's futile to speculate about what might have been |
| |
| |
| Egor | Дата: Четверг, 10.04.2014, 21:43 | Сообщение # 754 |
|
Группа: Пользователи
Сообщений: 267
| Ион цинка - это же окисленная форма?
|
|
| |
| |
| |
| FilIgor | Дата: Четверг, 10.04.2014, 21:59 | Сообщение # 755 |
 Эксперт
Группа: Супермодераторы
Сообщений: 6490
| Да.
|
|
|
It's futile to speculate about what might have been |
| |
| |
| Egor | Дата: Суббота, 12.04.2014, 11:02 | Сообщение # 756 |
|
Группа: Пользователи
Сообщений: 267
| Спасибо!
Помогите, пожалуйста, с такой задачей разобраться.
Не прибегаю к расчетам, укажите, в каком случае и почему восстановительная способность металлического цинка будет выше :
а) в 1М H2SO4
б) в 1М NH3.
Выведите выражение для стандартного потенциала пары [Zn(NH3)4]2+ / Zn0.
Разница в восстановительной способности Zn0 вызвана связыванием части Zn2+ в комплекс.
В отсутствие лигандов(в нашем случае H2SO4) полуреакция окисления цинка выглядит так
Zn0 -2e = Zn2+
В растворе аммиака цинк связывается в комплекс
Zn2+ + 4NH3 = [Zn(NH3)4]2+
β4 = [Zn(NH3)4]2+ / [Zn2+][NH3]4
[Zn2+] = [Zn(NH3)4]2+ / β4[NH3]4
Запишем выражение для стандартного потенциала пары Zn2+/Zn0
E = E0 + (0,059/n)*lg[Zn2+]/[Zn0]
Подставим концентрацию цинка
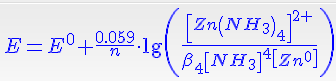
Чтобы получить выражение для стандартного потенциала новой пары ([Zn(NH3)4]2+ / Zn0), достаточно принять равными 1 моль/л концентрации всех веществ. Получаем
E = E0 + (0,059/n)*lg 1/β4
Получается, что потенциал, определяемый этим выражением, и является стандартным к новой паре, т.е.
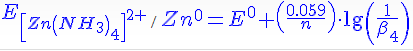
-------
Так как β4 >1 , 1/β4 < 1, значит, lg(1/β4) < 0 и потенциал новой пары меньше, чем потенциал исходной (Zn2+/Zn0).
Чем ниже потенциал, тем выше восстановительная способность. Следовательно, восстановительная способность цинка выше в растворе аммиака, чем в растворе серной кислоты.
Верно?
|
|
| |
| |
| |
| FilIgor | Дата: Суббота, 12.04.2014, 12:08 | Сообщение # 757 |
 Эксперт
Группа: Супермодераторы
Сообщений: 6490
| Верно.
|
|
|
It's futile to speculate about what might have been |
| |
| |
| Egor | Дата: Воскресенье, 13.04.2014, 00:38 | Сообщение # 758 |
|
Группа: Пользователи
Сообщений: 267
| Большое Вам спасибо!
Рассчитайте Кр между H2SeO3 и I- в растворе, где потенциал...
Будет такая реакция?
H2SeO3 + 4I- = Se + 2I2 + 3H2O
=====
Рассчитайте Кр между VO2+ и Fe(II) в растворе, где..
Реакция такая?
VO2+ + Fe2+ + 2H+ = VO2+ + Fe3+ + H2O
Сообщение отредактировал Egor - Воскресенье, 13.04.2014, 00:59 |
|
| |
| |
| |
| Egor | Дата: Воскресенье, 13.04.2014, 22:12 | Сообщение # 759 |
|
Группа: Пользователи
Сообщений: 267
| Fe3+ c ЭДТА реагирует в соотношении 1:1 ?
Fe3+ + Y4- = FeY-
|
|
| |
| |
| |
| FilIgor | Дата: Понедельник, 14.04.2014, 11:37 | Сообщение # 760 |
 Эксперт
Группа: Супермодераторы
Сообщений: 6490
| Цитата Egor (  ) c ЭДТА реагирует в соотношении 1:1
Да. 1:1.
Но вот в Вашем уравнении сомневаюсь. Железо (III) существует лишь в кислой среде, в которой ЭДТA не будет в форме Y4-
Вероятнее, будет так.
Fe3+ + H3Y- = FeY- + 3H+
|
|
|
It's futile to speculate about what might have been |
| |
| |
| Egor | Дата: Понедельник, 14.04.2014, 13:20 | Сообщение # 761 |
|
Группа: Пользователи
Сообщений: 267
| Спасибо!
Диметилглиоксимат никеля и глицинат меди - это же хелаты?
|
|
| |
| |
| |
| FilIgor | Дата: Понедельник, 14.04.2014, 13:31 | Сообщение # 762 |
 Эксперт
Группа: Супермодераторы
Сообщений: 6490
| Да.
|
|
|
It's futile to speculate about what might have been |
| |
| |
| nh | Дата: Пятница, 25.04.2014, 08:00 | Сообщение # 763 |
|
Группа: Пользователи
Сообщений: 1
| помогите!!!!Определить какой металл выделится в первую очередь при электролизе водных растворов солей.BaI2+CrI3+NiI2
|
|
| |
| |
| |
| FilIgor | Дата: Пятница, 25.04.2014, 10:01 | Сообщение # 764 |
 Эксперт
Группа: Супермодераторы
Сообщений: 6490
| Цитата nh (  ) помогите!!!!
Этого писать не надо. Раз Вы оставляете тут сообщение, и так понятно, что нужна помощь.
Цитата nh (  ) Определить какой металл выделится в первую очередь при электролизе водных растворов солей.BaI2+CrI3+NiI2
Смотрим потенциалы и видим, что наибольший потенциал у никеля. Значит, выделится в первую очередь.
Или (для школы) смотрим ряд напряжений и видим, что никель правее всех. Вывод тот же.
P.S. не стоит писать в чужих темах, создавайте свои (по правилам!).
|
|
|
It's futile to speculate about what might have been |
| |
| |
| wennek_fox | Дата: Четверг, 29.05.2014, 15:13 | Сообщение # 765 |
|
Группа: Пользователи
Сообщений: 3
| здравствуйте
я бы хотела уточнить следующее:
1. при реакции с разб. H2SO4 при комнатной температуре Cu не реагирует, а при нагревании?
2. реагирует ли с H2SO4 (конц.) медь при нагревании?
3. какие продукты будут в результате реакции: (NH4)2SO4 + H2S = ?
|
|
| |
| |
| |