|
Органическая химия. Вопросы.
|
|
| Egor | Дата: Четверг, 22.01.2015, 01:22 | Сообщение # 286 |
|
Группа: Пользователи
Сообщений: 267
| Есть реакция
HOOC-CH2-CHOH-COOH ----t0----> HOOC-CH=CH-COOH
Как понять какую кислоту мы получили - фумаровую или малеиновую?
|
|
| |
| |
| |
| Egor | Дата: Четверг, 22.01.2015, 01:57 | Сообщение # 287 |
|
Группа: Пользователи
Сообщений: 267
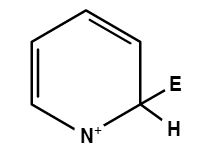
| Объясните, пожалуйста, почему такой резонанс является невыгодным?
|
|
| |
| |
| |
| Ефим | Дата: Четверг, 22.01.2015, 10:21 | Сообщение # 288 |

Группа: Супермодераторы
Сообщений: 1839
| Цитата Есть у нас тиофен. На 4 атома углерода приходится 6π-электронов, поэтому он является πе-избыточным. Есть у нас пиридин. На 6 атомов углерода приходится 8п-электронов (6п-электронов лично пиридина и пара электронов от азота). Он является пе-недостаточным.
В пиридине всего 6 пи-электронов (НЭП азота даже не сопряжена с пи-системой). Но в любом случае, характер пи-системы (избыточность - недостаточность) определяется не числом пи-электронов, а относительной (относительно бензола) электронной плотностью.
Атом азота в пиридине - акцептор, поэтому у него велик вклад резонансных форм с "плюсом" в цикле:
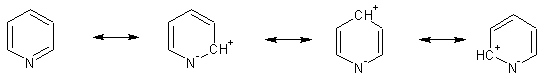
Электронная плотность пи-системы оказывается пониженной относительно бензола, что и на реакционной способности отражается.
У тиофена атом серы участвует в ароматической системе одной из своих НЭП, то есть является донором, что даёт большой вклад резонансов с "минусом" в цикле:
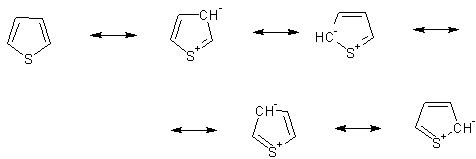
Электронная плотность пи-системы повышена относительно бензола, цикл - пи-избыточный.
Цитата Есть смесь бензола и тиофена, бромируем. Сначала бромируется тиофен. Из этого делаем вывод, что он более реакционно способный. За счет чего проявляется эта реакционная способность тиофена?
За счёт того, о чём говорилось выше. Тиофен более доступен для электрофила в силу более высокой электронной плотности пи-системы.
Цитата Egor (  ) Есть реакция HOOC-CH2-CHOH-COOH ----t0----> HOOC-CH=CH-COOH
Как понять какую кислоту мы получили - фумаровую или малеиновую?
В таких случаях обычно идёт транс-элиминирование и получается, соответственно транс-изомер. К тому же транс-изомеры, как правило, термодинамически выгоднее.
При выдерживании при 150С яблочная кислота превращается в фумаровую кислоту, но если нагревать быстро до 180С, то получается малеиновый ангидрид.
Цитата Egor (  ) Объясните, пожалуйста, почему такой резонанс является невыгодным?
Плюс на азоте - не есть хорошо. Азот - акцептор, нести положительный заряд ему совсем уж невыгодно.
Сообщение отредактировал Ефим - Четверг, 22.01.2015, 10:24 |
|
| |
| |
| |
| Egor | Дата: Пятница, 23.01.2015, 19:07 | Сообщение # 289 |
|
Группа: Пользователи
Сообщений: 267
| Спасибо!
Почему в анилине надо обязательно защищать NH2-группу?
|
|
| |
| |
| |
| Grey | Дата: Пятница, 23.01.2015, 19:21 | Сообщение # 290 |
|
Группа: Пользователи
Сообщений: 133
| Цитата Egor (  ) Спасибо! Почему в анилине надо обязательно защищать NH2-группу?
Насколько мне известно, защита групп применяется для синтетических целей.
А так чтобы обязательно защищать.. Первый раз слышу.
|
|
| |
| |
| |
| Ефим | Дата: Суббота, 24.01.2015, 15:58 | Сообщение # 291 |

Группа: Супермодераторы
Сообщений: 1839
| Цитата Egor (  ) Почему в анилине надо обязательно защищать NH2-группу?
Да, действительно - для какой именно реакции?
|
|
| |
| |
| |
| Egor | Дата: Суббота, 24.01.2015, 19:49 | Сообщение # 292 |
|
Группа: Пользователи
Сообщений: 267
| Когда хотим анилин ввести в реакцию с азотной кислотой, то сначала ацилируем NH2-группу, т.е. защищаем. А от чего защищать ее?
Подскажите, пожалуйста, как из ацетона получить 1,4-дикетон - СH3-CO-CH2-CH2-CO-CH3?
|
|
| |
| |
| |
| Grey | Дата: Суббота, 24.01.2015, 20:15 | Сообщение # 293 |
|
Группа: Пользователи
Сообщений: 133
| Цитата Egor (  ) Когда хотим анилин ввести в реакцию с азотной кислотой, то сначала ацилируем NH2-группу, т.е. защищаем. А от чего защищать ее?
В данном случае защита применяется от побочной реакции окисления.
Цитата Egor (  ) Подскажите, пожалуйста, как из ацетона получить 1,4-дикетон - СH3-CO-CH2-CH2-CO-CH3?
Вопрос как получить диацетилянтарный эфир?
Один из вариантов: подействовать на ацетоуксусный эфир (АУЭ) сильным основанием (к примеру, металлическим натрием) получит натр-АУЭ, далее окислить полученный продукт молекулярным йодом.
Сообщение отредактировал Grey - Суббота, 24.01.2015, 20:26 |
|
| |
| |
| |
| Ефим | Дата: Суббота, 24.01.2015, 20:34 | Сообщение # 294 |

Группа: Супермодераторы
Сообщений: 1839
| Цитата Egor (  ) Подскажите, пожалуйста, как из ацетона получить 1,4-дикетон - СH3-CO-CH2-CH2-CO-CH3?
Цитата Grey (  ) Например, при нагревании диацетилянтарного эфира получается данный продукт.
Это да, но надо ведь из ацетона.
Скажем так (исходя из максимально жёсткого условия, что кроме ацетона больше ничего органического нет):
ацетон ----> уксусная кислота (окислительное расщепление по Попову)
ацетон ----> изопропанол (восстановление)
изопропанол + уксусная кислота ----> изопропилацетат (этерификация)
изопропилацетат ----> изопропилацетоуксусный эфир (сложноэфирная конденсация)
ацетон + хлор ----> хлорацетон (хлорирование)
изопропилацетоацетат + Na ----> натрийацетоуксусный эфир
натрийацетоуксусный эфир + хлорацетон ----> 2-ацетонилацетоуксусный эфир (название очень несистематическое)
2-ацетонилацетоуксусный эфир ----> гександион-2,4 (кетонное расщепление замещённого ацетоуксусного эфира)
Сообщение отредактировал Ефим - Суббота, 24.01.2015, 20:37 |
|
| |
| |
| |
| Grey | Дата: Суббота, 24.01.2015, 20:38 | Сообщение # 295 |
|
Группа: Пользователи
Сообщений: 133
| Цитата Ефим (  ) Это да, но надо ведь из ацетона. Скажем так (исходя из максимально жёсткого условия, что кроме ацетона больше ничего органического нет):
ацетон - уксусная кислота (окислительное расщепление по Попову)
ацетон - изопропанол (восстановление)
изопропанол + уксусная кислота - изопропилацетат (этерификация)
изопропилацетат - изопропилацетоуксусный эфир (сложноэфирная конденсация)
ацетон + хлор - хлорацетон (хлорирование)
изопропилацетоацетат + Na ----> натрийацетоуксусный эфир
натрийацетоуксусный эфир + хлорацетон - 2-ацетонилацетоуксусный эфир (название очень несистематическое)
2-ацетонилацетоуксусный эфир - гександион-2,4 (кетонное расщепление замещённого ацетоуксусного эфира)
Куда я смотрел? Не заметил, что нужно получить из ацетона.. 
|
|
| |
| |
| |
| Egor | Дата: Воскресенье, 25.01.2015, 01:51 | Сообщение # 296 |
|
Группа: Пользователи
Сообщений: 267
| Ох, вот это да.
Спасибо большое!
Кто является лучшими нуклеофилами: первичные, вторичные, третичные, ароматические?
На примере основности я разобрался, но нуклеофильность - это же совсем другая вещь.
Объясните, пожалуйста.
|
|
| |
| |
| |
| Grey | Дата: Воскресенье, 25.01.2015, 09:03 | Сообщение # 297 |
|
Группа: Пользователи
Сообщений: 133
| Цитата Egor (  ) Кто является лучшими нуклеофилами: первичные, вторичные, третичные, ароматические? На примере основности я разобрался, но нуклеофильность - это же совсем другая вещь.
Объясните, пожалуйста.
Я не специалист, но на мой взгляд тут сложно сделать какой-либо прогноз.
В различных растворителях нуклеофильные свойства будут меняться.
Лучше проверить на практике.
Сообщение отредактировал Grey - Воскресенье, 25.01.2015, 09:04 |
|
| |
| |
| |
| Ефим | Дата: Воскресенье, 25.01.2015, 18:40 | Сообщение # 298 |

Группа: Супермодераторы
Сообщений: 1839
| Цитата Egor (  ) Кто является лучшими нуклеофилами: первичные, вторичные, третичные, ароматические? На примере основности я разобрался, но нуклеофильность - это же совсем другая вещь.
Объясните, пожалуйста.
Вопрос действительно, не имеет однозначного ответа. Можно только обрисовать картину в целом, памятуя о том, что в конкретных случаях могут возникать и исключения.
Если рассматривать нуклеофильное присоединение у насыщенного углерода, то изрядную роль в стабильности пятикоординированного переходного состояния (а значит и скорости замещения) играют стерические эффекты.
Ароматические амины, как правило, менее нуклеофильны, чем алифатические, за исключением случаев сильной стерической загруженности алифатического амина. Тут играет роль и электронный, и стерический эффекты.
В ряду алифатических аминов нуклеофильность, как правило, уменьшается в ряду первичный - вторичный - третичный, но и тут могут быть варианты. Ди-третбутиламин может быть слабее триметиламина, особенно, если субстрат сам достаточно "лохматый".
Вообще, нуклеофильность - характеристика не реагента как такового, а поведения реагента в системе реагент - субстрат - растворитель.
Сообщение отредактировал Ефим - Воскресенье, 25.01.2015, 18:41 |
|
| |
| |
| |
| Egor | Дата: Пятница, 24.04.2015, 18:31 | Сообщение # 299 |
|
Группа: Пользователи
Сообщений: 267
| Помогите, пожалуйста, разобраться с такой задачей.
Не сталкивался с такими ацеталями..
Цитата Из каких карбонильных соединений и спиртов были получены следующие ацетали (кетали)? |
|
| |
| |
| |
| Ефим | Дата: Пятница, 24.04.2015, 21:28 | Сообщение # 300 |

Группа: Супермодераторы
Сообщений: 1839
| Цитата Egor (  ) Помогите, пожалуйста, разобраться с такой задачей. Не сталкивался с такими ацеталями..
а) циклогексанон и этанол
б) циклопентанон и 1,3-пропиленгликоль
в) А тут особь статья - внутримолекулярное кеталирование. Исходник -
HO-CH2-CH2-CH2-CH2-CO-CH2-CH2-CH2-CH2-OH (1,9-дигидроксинонанон-5)
|
|
| |
| |
| |