| Kimi | Дата: Понедельник, 11.01.2016, 00:47 | Сообщение # 1 |
|
Группа: Пользователи
Сообщений: 4
| Добрый день!
Обменная кислотность обусловлена присутствием в почвенномпоглощающем комплексе (ППК) ионов
водорода и алюминия. С каким индикатором лучше проводить титрование при
определении обменной кислотности почвы?
При определение почвенную вытяжку обрабатывают раствором хлорида калия. Получаем хлорид алюминия, который при гидролизе дает соляную кислоту. Ее и оттитровывают 0,1 н раствором гидроксида натрия.Получается концентрация кислоты зависит от степени гидролиза и концентрации хлорида алюминия (ее нет по условию). Следовательно концентрация маленькая, то есть гидролизуемый раствор хлорида алюминия можно отнести к разряду слабых кислот, при титрировании которых сильным основанием следует использовать индикатор переход, которого в щелочном диапазоне - фенолфталеин.
он и используется по факту.
но вот как это доказать расчетно?
Концентрации кислоты нет, соли тоже нет...
попробовала рассчитать рН в точке эквивалетности по формуле (возможно она и не подходит)
pH =7-1/2∙ pKосн + 1/2 lgCсоли
концентрацию соли взяла различную, константа диссоциации первой ступени Al(OH)3=8,3*10-9
концентрация соли
рН
111,04046
0,1
10,54046
0,01
10,04046
0,001
9,540461
0,0001
9,040461
0,00001
8,540461
0,000001
8,040461
0,0000001
7,540461
Тоже ничего не дало... так значения выходят за рамки работы фенолфталеина
В итоге запуталась 
|
|
| |
| |
| |
| FilIgor | Дата: Понедельник, 11.01.2016, 18:32 | Сообщение # 2 |
 Эксперт
Группа: Супермодераторы
Сообщений: 6490
| Цитата Kimi (  ) При определение почвенную вытяжку обрабатывают раствором хлорида калия. Получаем хлорид алюминия,
Чертовски интересно посмотреть на эту реакцию. Чушь какая-то...
А так, все просто. У МО переход в интервале рН 2,9-4,0. Если кислоты в самом деле мало, рН может быть >4, и тогда тогда точка эквивалентности лежит вне пределов работы индикатора.
|
|
|
It's futile to speculate about what might have been |
| |
| |
| Kimi | Дата: Понедельник, 11.01.2016, 21:35 | Сообщение # 3 |
|
Группа: Пользователи
Сообщений: 4
| Цитата FilIgor (  ) А так, все просто. У МО переход в интервале рН 2,9-4,0. Если кислоты в самом деле мало, рН может быть >4, и тогда тогда точка эквивалентности лежит вне пределов работы индикатора.
вот тут то и путаюсь, титрование соляной кислоты щелочью при не сильном разбавление как раз имеет перехд в зоне МО, но в ГОСТовской методики титруют до 8,2, либо по изменению окраски фенолфталеина
"Принцип метода. Метод основан на том, что вытяжку из почвы титруют раствором гидроксида натрия до рН 8,2, используя: рН-метр с блоком автоматического титрования.
Ход анализа. 25 см3 отфильтрованной жидкости переносят в стакан вместимостью 100 см3. Стакан с вытяжкой устанавливают на магнитную мешалку, помещают в него магнитик, погружают в раствор электродную пару рН-метра и кончик дозирующей трубки бюретки. На блоке автоматического титрования задают значение рН конечной точки титрования, равное 8,2, и время выдержки 30 с. Включают блок автоматического титрования, рН-метр и магнитную мешалку. Когда показания рН-метра установятся, открывают кран бюретки, титруют пробу до рН 8,2 и регистрируют расход щелочи по бюретке. Аналогично проводят титрование 25 см3 1 М раствора КСl (холостое титрование)." http://agrohimija24.ru/praktik....-1.html , ГОСТ 26484-85
Цитата FilIgor (  ) Цитата Kimi ()При определение почвенную вытяжку обрабатывают раствором хлорида калия. Получаем хлорид алюминия,
Чертовски интересно посмотреть на эту реакцию. Чушь какая-то..
"Значение анализа и сущность метода. При взаимодействии почвы с 1 М (1 н.) раствором КСl при рН солевой вытяжки меньше 5,0-5,3, в него наряду с ионами водорода переходит и алюминий по следующей схеме:
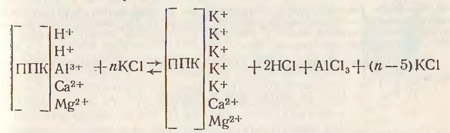
Хлористый алюминий в водном растворе гидролитически расщепляется с образованием дополнительного количества соляной кислоты. Таким образом, после обработки почвы раствором хлористого калия находят общую обменную кислотность, вызываемую вытесненными ионами водорода и добавочным количеством водородных ионов, образующихся при гидролитическом расщеплении хлористого алюминия."
http://agrohimija24.ru/praktik....ya.html
http://www.vashdom.ru/gost/26483-85/
возможно следует учитывать, что еще помимо катионов алюминия, там и катионы водорода. но все равно что-то не догоняю почему фенолфталеин, так как все равно в итоге солянку титруют щелочью
|
|
| |
| |
| |
| FilIgor | Дата: Понедельник, 11.01.2016, 21:52 | Сообщение # 4 |
 Эксперт
Группа: Супермодераторы
Сообщений: 6490
| Теперь ясно - взаимодействие по типу катионообменной смолы.
Цитата Kimi (  ) почему фенолфталеин, так как все равно в итоге солянку титруют щелочью
Потому и ф.ф., что титруют щелочью. У Вас по методике титруют до рН 8,2, а МО такой диапазон не ловит.
|
|
|
It's futile to speculate about what might have been |
| |
| |
| Kimi | Дата: Понедельник, 11.01.2016, 22:14 | Сообщение # 5 |
|
Группа: Пользователи
Сообщений: 4
| методику, то я нашла, чтобы проверится,
но задание просит выбрать индикатор, я думала может рассчитать как то можно,
теория дает либо мо либо фф
|
|
| |
| |
| |
| FilIgor | Дата: Понедельник, 11.01.2016, 22:26 | Сообщение # 6 |
 Эксперт
Группа: Супермодераторы
Сообщений: 6490
| Цитата Kimi (  ) но задание просит выбрать индикатор,
Вот и выберите на основании заданного в методике рН 8,2.
Цитата Kimi (  ) я думала может рассчитать как то можно,
Не ищите сложное в простом. Все уже давно рассчитано умными дядями. Хотите - постройте кривую титрования кислоты щелочью. Вполне наглядно.
|
|
|
It's futile to speculate about what might have been |
| |
| |
| Kimi | Дата: Понедельник, 11.01.2016, 22:56 | Сообщение # 7 |
|
Группа: Пользователи
Сообщений: 4
| Спасибо, так и сделаю)))
кривую, правда, строить не буду - нет концентрации кислоты (без нее не умею)
|
|
| |
| |
| |