|
Одновалентная медь
|
|
| Miriada | Дата: Среда, 30.03.2016, 19:10 | Сообщение # 1 |

Группа: Пользователи
Сообщений: 699
| Здравствуйте! Не могли бы Вы помочь разобраться? Ниже приведён механизм каталитической реакции. Катализатор медь двухвалентная . Здесь металл не изменяет своей степени окисления, и вроде бы всё понятно. А что будет в случае меди одновалентной (CuCl)? Сначала окисление?
Сообщение отредактировал Miriada - Среда, 30.03.2016, 19:10 |
|
| |
| |
| |
| Ефим | Дата: Среда, 30.03.2016, 20:11 | Сообщение # 2 |

Группа: Супермодераторы
Сообщений: 1839
| Цитата Miriada (  ) дравствуйте! Не могли бы Вы помочь разобраться? Ниже приведён механизм каталитической реакции. Катализатор медь двухвалентная . Здесь металл не изменяет своей степени окисления, и вроде бы всё понятно. А что будет в случае меди одновалентной (CuCl)? Сначала окисление?
На картинке, на мой взгляд - явные ошибки.
Второй интермедиат (который в скобках), видимо так должен выглядеть:

А то у вас там и азот четырёхкоординированный, и медь трёхкоординированная - и всё без зарядов.
И получается этот интермедиат БЕЗ участия кислорода, только с выделением HCl.
Далее, окисляется кислородом как раз этот самый интермедиат:
[интермедиат-2] + 1/2O2 ----> продукт + CuOHCl
А последняя реакция - простая нейтрализация (там кислород не нужен):
CuOHCl + HCl ----> CuCl2 + H2O
Каталитический цикл замкнулся.
С одновалентной медью очевидно, потребуется больше кислорода, то есть он будет участвовать уже на стадии образования интермедиата-2.
P.S. А откуда взят нарисованный механизм?
Тут можно другой механизм предложить. Интермедиат-2 разваливается с образованием продукта и выделением металлической меди и HCl. А замыканием цикла является окисление меди и реакция с HCl (Cu + 1/2O2 + 2HCl = CuCl2 + H2O).
Этот механизм симпатичен тем, что логичен - классический ред-окс катализ.
Сообщение отредактировал Ефим - Среда, 30.03.2016, 20:22 |
|
| |
| |
| |
| Miriada | Дата: Среда, 30.03.2016, 20:32 | Сообщение # 3 |

Группа: Пользователи
Сообщений: 699
| Да, я в курсе, что там ошибка. По идее, связь пунктирной линией изображаем. Хотя, и в этом случае лучше, думаю, писать частичные заряды?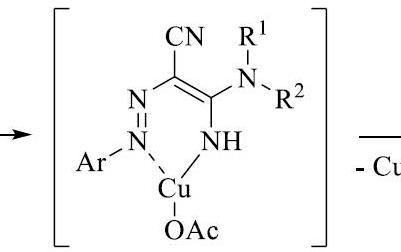
|
|
| |
| |
| |
| Miriada | Дата: Среда, 30.03.2016, 20:46 | Сообщение # 4 |

Группа: Пользователи
Сообщений: 699
| Это не я рисовала. Просто нашла.
|
|
| |
| |
| |
| Miriada | Дата: Среда, 30.03.2016, 20:50 | Сообщение # 5 |

Группа: Пользователи
Сообщений: 699
| То есть тут объединили стадию присоединения меди и последующую стадию окисления интермедиата. Это не слишком грамотно?
|
|
| |
| |
| |
| Miriada | Дата: Среда, 30.03.2016, 20:56 | Сообщение # 6 |

Группа: Пользователи
Сообщений: 699
| А двухвалентная медь из одновалентной получается в результате диспропорционирования? 2 CuCl----> CuCl2 + Cu ( ничего другого на ум не приходит). Ведь процесс катализирует именно двухвалентная медь.
|
|
| |
| |
| |
| Ефим | Дата: Среда, 30.03.2016, 21:16 | Сообщение # 7 |

Группа: Супермодераторы
Сообщений: 1839
| Цитата Miriada (  ) Это не я рисовала. Просто нашла.
Вообще, нарисованный механизм мне не нравится. Какой-то он "неестественный". Можно куда более приятный глазу механизм нарисовать :)
Цитата Miriada (  ) То есть тут объединили стадию присоединения меди и последующую стадию окисления интермедиата. Это не слишком грамотно?
В данном случае - неграмотно.
Цитата Miriada (  ) А двухвалентная медь из одновалентной получается в результате диспропорционирования? 2 CuCl----> CuCl2 + Cu ( ничего другого на ум не приходит). Ведь процесс катализирует именно двухвалентная медь.
Тут вопрос сложнее. Возможно присоединение одновалентной меди, и окисление уже медного производного, просто больше кислорода нужно (в элементарном акте). Возможно окисление собственно одновалентной меди с последующим присоединением. Возможно и диспропорционирование.
При ред-окс катализе исходное состояние катализатора, как правило - не важно. Поскольку окислитель относительно катализатора в избытке - в каком виде ни вводи медь - она включится в каталитический цикл. То, что для этого нужно больше кислорода - не существенно, это избыток относительно небольшой, "каталитический" :)
А в чём, вообще - смысл вопроса об одновалентной меди?
|
|
| |
| |
| |
| Miriada | Дата: Среда, 30.03.2016, 21:25 | Сообщение # 8 |

Группа: Пользователи
Сообщений: 699
| Цитата А в чём, вообще - смысл вопроса об одновалентной меди?
Процесс катализируется и солями одновалентной, и двухвалентной меди. Вопрос заключался в том, каким образом одновалентная медь вступает в процесс. Но Вы уже написали, что здесь однозначно ничего нельзя сказать. Но всё равно в обоих случаях интермедиат будет иметь одинаковое строение.
|
|
| |
| |
| |
| Miriada | Дата: Среда, 30.03.2016, 21:29 | Сообщение # 9 |

Группа: Пользователи
Сообщений: 699
| Единственное, что катализатор ведь должен регенерироваться. CuOHCl + HCl ----> CuCl2 + H2O (мы ведь должны получить снова именно одновалентную медь...)
|
|
| |
| |
| |
| Ефим | Дата: Среда, 30.03.2016, 22:25 | Сообщение # 10 |

Группа: Супермодераторы
Сообщений: 1839
| Цитата Miriada (  ) Единственное, что катализатор ведь должен регенерироваться. CuOHCl + HCl ----> CuCl2 + H2O (мы ведь должны получить снова именно одновалентную медь...)
С точки зрения практики - это не обязательно. Но, если речь идёт о задаче, где изначально подразумевается, что цикл может замыкаться как через двух-, так и через одновалентную медь, тут надо подумать. Примерно я представляю, как это нарисовать, но время позднее. "Я подумаю об этом завтра"(С) 
|
|
| |
| |
| |
| Miriada | Дата: Четверг, 31.03.2016, 21:23 | Сообщение # 11 |

Группа: Пользователи
Сообщений: 699
| Ефим, я правильно понимаю, что электронодонорные заместители в гидразоне стабилизируют переходное состояние? Амины с электронодонорными заместителями также легко должны вступать в реакцию (первая стадия - присоединение к электрофильному атому углерода в цианогруппе)?
|
|
| |
| |
| |
| Miriada | Дата: Пятница, 01.04.2016, 20:51 | Сообщение # 12 |

Группа: Пользователи
Сообщений: 699
| Вот, например, приведён ряд аминов, которые вступают в реакцию присоединения. Насколько я понимаю, самые реакционносопособные здесь а), в) и е) за счёт положительного индуктивного эффекта алкильных групп. В случаях б), г) и д) имеет место отрицательный индуктивный эффект. Они, соответственно, медленнее вступают в реакцию присоединения. Верно?
Сообщение отредактировал Miriada - Пятница, 01.04.2016, 21:12 |
|
| |
| |
| |
| Ефим | Дата: Пятница, 01.04.2016, 20:51 | Сообщение # 13 |

Группа: Супермодераторы
Сообщений: 1839
| Цитата Miriada (  ) Ефим, я правильно понимаю, что электронодонорные заместители в гидразоне стабилизируют переходное состояние? Амины с электронодонорными заместителями также легко должны вступать в реакцию (первая стадия - присоединение к электрофильному атому углерода в цианогруппе)?
Честно говоря - я не понял о чём речь. При чём тут вообще - гидразон? Первая стадия - присоединение амина к нитрилу с образованием амидиновой группировки. Эта реакция идёт с любым нитрилом, при достаточно высокой температуре. Вторая циано-группа, безусловно активирует первую (чисто по индуктивному эффекту), но принципиальной роля не играет. А гидразон тут, или не гидразон - вот это уже, для первой стадии, абсолютно не важно.
|
|
| |
| |
| |
| Miriada | Дата: Пятница, 01.04.2016, 21:02 | Сообщение # 14 |

Группа: Пользователи
Сообщений: 699
| Да, на первую стадию природа заместителя влияния,действительно, не оказывает. ( Я поторопилась). Но оказывает, как я понимаю, влияние на стабильность металлокомплекса. Донорные заместители увеличивают стабильность.
Сообщение отредактировал Miriada - Пятница, 01.04.2016, 21:13 |
|
| |
| |
| |
| Ефим | Дата: Пятница, 01.04.2016, 21:24 | Сообщение # 15 |

Группа: Супермодераторы
Сообщений: 1839
| Цитата Miriada (  ) Вот, например, приведён ряд аминов, которые вступают в реакцию присоединения. Насколько я понимаю, самые реакционносопособные здесь а), в) и е) за счёт положительного индуктивного эффекта алкильных групп. В случаях б), г) и д) имеет место отрицательный индуктивный эффект. Они, соответственно, медленнее вступают в реакцию присоединения. Верно?
Ну, прямо скажем - большой разницы в ряду а-б-в-г-д нет, там действуют слабые эффекты второго порядка (индуктивность через две связи).
Амин е) тут будет, пожалуй, самым "ленивым" в этом ряду, из-за своей повышенной "лохматости". В циклические аминах азот свободнее, ввиду "зажатости" алкильного хвоста в определённых конформациях.
Ну, в порядке перфекционистского (уф!) подхода можно выстроить ряд а > в > г > д > б > е
Сообщение отредактировал Ефим - Пятница, 01.04.2016, 21:28 |
|
| |
| |
| |