|
Вопросы по неорганической химии
|
|
| FilIgor | Дата: Пятница, 19.02.2016, 22:08 | Сообщение # 811 |
 Эксперт
Группа: Супермодераторы
Сообщений: 6490
| Да там в ходе титрования щелочью образуется пара H2PO4-/HPO42-, обладающая буферными свойствами. Поэтому не будет ошибкой сказать, что щелочь добавляется к буферу, хотя и не в этом суть. Когда буферная емкость будет исчерпана, будет скачек титрования. Пологий и небольшой.
|
|
|
It's futile to speculate about what might have been |
| |
| |
| Twilight | Дата: Понедельник, 22.02.2016, 17:13 | Сообщение # 812 |
|
Группа: Пользователи
Сообщений: 32
| Чему будет равен рН раствора, если смешать 100 мл 0,2М раствора NaOH и 250 мл 0,3М раствора уксусной кислоты, если величина рКа уксусной кислоты равна 4,76?
OH- + CH3COOH <----> CH3COO- + H2O
n(OH-) = 0,1 * 0,2 = 0,02 mol
n(CH3COOH) = 0,25 * 0,3 = 0,075 mol
pH = pKa + log [CH3COO-] / [CH3COOH]
pH = 4,76 + log (0,2 / 0,2) = 4,76
Верно?
|
|
| |
| |
| |
| FilIgor | Дата: Понедельник, 22.02.2016, 21:25 | Сообщение # 813 |
 Эксперт
Группа: Супермодераторы
Сообщений: 6490
| Неверно.
|
|
|
It's futile to speculate about what might have been |
| |
| |
| Twilight | Дата: Вторник, 23.02.2016, 17:49 | Сообщение # 814 |
|
Группа: Пользователи
Сообщений: 32
| Должны же быть концентрации, а не количество вещества
OH- + CH3COOH <----> CH3COO- + H2O
n(OH-) = 0,1 * 0,2 = 0,02 mol
n(CH3COOH) = 0,25 * 0,3 = 0,075 mol
С (CH3COO-) = 0,02 / 0,35 = 0,057 моль/л
т.к. n(CH3COO-) = n(CH3COOH), то
С (CH3COOH) = 0,057 моль/л
pH = pKa + log [CH3COO-] / [CH3COOH]
pH = 4,76 + log (0,057 / 0,057) = 4,76
|
|
| |
| |
| |
| FilIgor | Дата: Вторник, 23.02.2016, 17:51 | Сообщение # 815 |
 Эксперт
Группа: Супермодераторы
Сообщений: 6490
| Цитата Twilight (  ) Должны же быть концентрации, а не количество вещества
Совершенно необязательно. Ведь под логарифмом отношение. А отношение количеств будет равно отношению концентраций - объемы сократятся.
Цитата Twilight (  ) т.к. n(CH3COO-) = n(CH3COOH), то
С чего Вы это взяли?
|
|
|
It's futile to speculate about what might have been |
| |
| |
| Twilight | Дата: Вторник, 23.02.2016, 18:00 | Сообщение # 816 |
|
Группа: Пользователи
Сообщений: 32
| Гидроксида у нас 0,02 моль, значит, столько же прореагирует и уксусной кислоты (0,075 - 0,02 = 0,055 моль в избытке).
Так как везде стехиометрические коэффициенты равны 1, то и ацетат-иона будет 0,02 моль.
Почему это неверно?
|
|
| |
| |
| |
| Twilight | Дата: Вторник, 23.02.2016, 18:02 | Сообщение # 817 |
|
Группа: Пользователи
Сообщений: 32
| Стоп. Среда же должна быть щелочной.
|
|
| |
| |
| |
| FilIgor | Дата: Вторник, 23.02.2016, 18:03 | Сообщение # 818 |
 Эксперт
Группа: Супермодераторы
Сообщений: 6490
| Цитата Twilight (  ) Почему это неверно?
Это-то верно. Но почему Вы концентрацию ацетат-иона приравняли к оставшейся кислоте? Ее-то концентрация почему должна быть такая же?
Цитата Twilight (  ) Стоп. Среда же должна быть щелочной.
Да с чего вдруг... с кислотой разберитесь.
|
|
|
It's futile to speculate about what might have been |
| |
| |
| Twilight | Дата: Вторник, 23.02.2016, 18:14 | Сообщение # 819 |
|
Группа: Пользователи
Сообщений: 32
| Цитата Но почему Вы концентрацию ацетат-иона приравняли к оставшейся кислоте? Ее-то концентрация почему должна быть такая же?
Равновесие в системе будет при 0,02 моль уксусной кислоты, еще 0,055 моль будет плавать в избытке.
Неужели C[CH3COOH] = 0,055 моль.. Не понимаю, почему так должно быть.
|
|
| |
| |
| |
| FilIgor | Дата: Вторник, 23.02.2016, 18:24 | Сообщение # 820 |
 Эксперт
Группа: Супермодераторы
Сообщений: 6490
| Цитата Twilight (  ) Не понимаю, почему так должно быть.
Вы не понимаете, потому что у Вас каша из концентраций и количеств вещества. 0,055 - количество, а не концентрация.
Сами же и пишете:
Цитата Twilight (  ) 0,075 - 0,02 = 0,055 моль в избытке
Казалось бы, все понятно, что тут непонятного?
Ну и дальше все просто:
pH = 4,76 + log (0,02 / 0,055) = ...
Но Вас понесло куда-то...
Хотате - пересчитайте 0,02 и 0,055 на концентрации (но только тогда и то и другое, а не один лишь ацетат!) - то же самое выйдет eventually.
|
|
|
It's futile to speculate about what might have been |
| |
| |
| Twilight | Дата: Вторник, 23.02.2016, 19:02 | Сообщение # 821 |
|
Группа: Пользователи
Сообщений: 32
| Чему равна величина рН 0,1 М раствора имидазола? Сколько нужно добавить 1М раствора HCl, чтобы приготовить 100 мл 0,1 М имидазольного буфера с рН 6,8, если величина рКа имидазола равна 7,05?
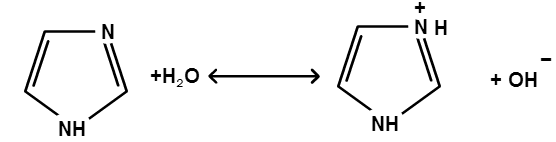
Ка = [имидазол+] * [OH-] / [имидазол] = 10-7,05
Пусть концентрация имидазол-иона х моль/л,
тогда концентрация имидазола (0,1 - х)
х2 / (0,1 - х) =10-7,05
х = 0,0000944 моль/л
pOH = 4,02
pH = 9,98
Так?
Второй вопрос задачи.
pH = pKa + lg [имидазол] / [имидазол+]
6,8 = 7,05 + lg [имидазол] / [имидазол+]
lg [имидазол] / [имидазол+] = -0,25
[имидазол] / [имидазол+] = 0,56
n(имидазола) = 0,1 * 0,1 = 0,01 моль
0,01 / [имидазол+] = 0,56
[имидазол+] = 0,017 mol
n(HCl) = n(имидазол+) = 0,017 mol
Получается, что нужно добавить 0,017 мл соляной кислоты.
Так?
|
|
| |
| |
| |
| Twilight | Дата: Вторник, 23.02.2016, 19:13 | Сообщение # 822 |
|
Группа: Пользователи
Сообщений: 32
| Цитата чтобы приготовить 100 мл 0,1 М имидазольного буфера |
|
| |
| |
| |
| FilIgor | Дата: Вторник, 23.02.2016, 19:19 | Сообщение # 823 |
 Эксперт
Группа: Супермодераторы
Сообщений: 6490
| Цитата Twilight (  ) Я подумал, что используя эти данные, мы сможем найти количество в-ва самого имидазола.
Да-да, все верно. Это я уже не сразу сообразил.
Единственно, что мне не нравится - это само условие: что понимать под 0,1 М буфер: общую концентрацию или только имидазольной формы.
Если только ее, то ход решения верен, неверен только ответ.
|
|
|
It's futile to speculate about what might have been |
| |
| |
| Twilight | Дата: Вторник, 23.02.2016, 19:30 | Сообщение # 824 |
|
Группа: Пользователи
Сообщений: 32
| Цитата Сколько нужно добавить 1М раствора HCl
C = n / V
1 = 0,017 mol / V
V = 0,017 л
Разве не так? Тут вроде бы всё просто, не знаю, где ошися
|
|
| |
| |
| |
| FilIgor | Дата: Вторник, 23.02.2016, 19:37 | Сообщение # 825 |
 Эксперт
Группа: Супермодераторы
Сообщений: 6490
| Цитата Twilight (  ) Получается, что нужно добавить 0,017 мл соляной кислоты.
Цитата Twilight (  ) V = 0,017 л
Сравните сами.
И, повторюсь, я бы решил иначе. Все-таки в условии написано, " Сколько нужно добавить 1М раствора HCl, " - я бы это понял так, что к 0,1 М раствору добавляют кислоты, вследствие чего часть имидазола переходит в протонированную форму [имидазол+], но ведь концентрация имидазола при этом пропорционально убывает.
Тогда уже нельзя писать 0,01 / [имидазол+] = 0,56
Надо тогда решать уравнение типа (0,01 - х)/х = 0,56. Улавливаете идею?
Но - смотрите сами, я не настаиваю. Может быть, я и ошибаюсь.
|
|
|
It's futile to speculate about what might have been |
| |
| |