| plick | Дата: Среда, 30.07.2014, 11:18 | Сообщение # 1 |

Группа: Супермодераторы
Сообщений: 876
| В данной теме будет рассмотрен метод образования комплексных ионов с точки зрения метода валентных связей, а также типы изомерии в комплексных ионах.
При рассмотрении кратких теоретических основ автор не объясняет такие понятия как гибридизация, типы гибридизации, изомерия. Подразумевается, что данные понятия, а также основы строения атома и теории МВС уже изучены.
Итак, краткие основы теории.
Все комплексные ионы образуются за счет ковалентных и ДА связей иона (атома) комплексообразователя.
Орбитали иона (атома) комплексообразователя всегда находятся в гибридном состоянии. Тип гибридизации и геометрическая форма комплексного иона зависят, в первую очередь, от типа лигандов, их дентатности и количества лигандов. Второстепенно, тип гибридизации зависит от самого комплексообразователя.
Зависимость типа гибридизации от типа лигандов определяется так называемым энергетическим полем лиганда. Все лиганды располагаются в так называемый спектрохимический ряд "ряд активности и силы поля" лигандов:
I- < Br- < Cl- < NCS- < NO3- < F- < OH- < H2O < H- < NH3 < NO2- < CN- < NO < CO.
Лиганды, начиная с молекулы воды и заканчивая аммиаком - лиганды среднего поля (иногда их объединяют с лигандами слабого поля).
Лиганды, начиная с нитрогруппы (нитрит-иона) и заканчивая молекулой СО - лиганды сильного поля.
Практически все органические лиганды, образующие хелаты, являются лигандами сильного поля.
Все лиганды сильного поля вступают во взаимодействие с внутренними орбиталями комплексообразорвателя, "заставляют" спариваться неспаренные электроны и образуют низкоспиновые, внутриорбитальные комплексы.
Лиганды слабого поля (и частично среднего) не взаимодействуют с внутренними орбиталями комплексообразорвателя, и образуют высокоспиновые, внешнеорбитальные комплексы.
Также, тип гибридизации зависит от самого вида комплексообразователя. Так, катион кобальта Со3+ даже при взаимодействии с лигандами среднего поля (например с молекулами воды и аммиака) образует низкоспиновые комплексы, в отличие от катиона железа, который образует с водой высокоспиновый комплекс. Катион хрома(III) также образует низкоспиновые комплексы с лигандами среднего поля.
Видам гибридизации отвечают следующие геометрические формы ионов:
sp - линейная
sp2 или d2s - плоская треугольная
sp3 или d3s - тетраэдр
dsp2 или sp2d - плоская квадратная
sp3d или dsp3 - тригональная бипирамида или квадратная пирамида соответственно
sp3d2 или d2sp3 - октаэдр (в случае хелатов или разнолигандных комплексов - искаженный октаэдр).
sp3d3 - пентагональная бипирамида.
Рассмотрим образование некоторых комплексных ионов.
Сообщение отредактировал plick - Пятница, 01.08.2014, 13:40 |
|
| |
| |
| |
| plick | Дата: Среда, 30.07.2014, 16:58 | Сообщение # 2 |

Группа: Супермодераторы
Сообщений: 876
| Задача 1.1.
Рассмотреть строение комплексного гексафтороферрат(II)-иона [FeF6]4-, определить тип гибридизации, геометрическую форму и магнитные свойства.
Для начала, записываем электронно-графическую формулу валентных электронных орбиталей атома железа:

Затем, определяемся с электронно-графической формулой катиона железа(II). Катион Fe2+ образуется за счет "отрыва" 2-х электронов с 4s-орбитали:

Теперь определяемся с лигандами.
Каждый фторид-ион является лигандом слабого поля, то есть не вступает во взаимодействие с внутренними орбиталями катиона железа (с 3d-орбиталями).
Каждый фторид-ион предоставляет одну неподеленную электронную пару (НЭП) на свободные орбитали катиона железа:
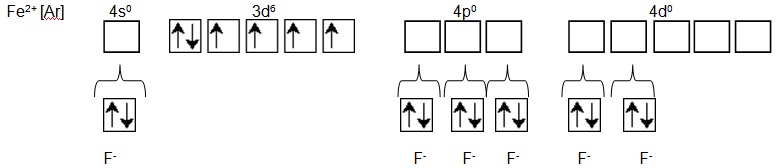
В результате этого образуются 6 донорно-акцепторных связей (ДА-связей).
4s-орбиталь; три 4р-орбитали и две 4d-орбитали гибридизуются. Таким образом, тип гибридизации - sp3d2. Геометрическая форма - правильный октаэдр.
Так как у катиона железа имеются неспаренные электроны, следовательно, данный комплексный ион - парамагнитен.
Сообщение отредактировал plick - Пятница, 01.08.2014, 12:40 |
|
| |
| |
| |
| plick | Дата: Среда, 30.07.2014, 17:40 | Сообщение # 3 |

Группа: Супермодераторы
Сообщений: 876
| Задача 1.2.
Рассмотреть строение комплексного гексацианоферрат(II)-иона [Fe(CN)6]4-, определить тип гибридизации, геометрическую форму и магнитные свойства.
Аналогично, как и в задаче 1.1, записываем электронно-графическую формулу валентных электронных орбиталей атома железа и катиона железа(II):


Теперь определяемся с лигандами.
Каждый цианид-ион является лигандом сильного поля, то есть вступает во взаимодействие с внутренними орбиталями катиона железа (с 3d-орбиталями), в результате чего происходит спаривание электронов:
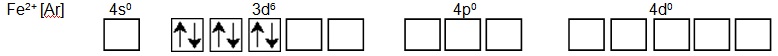
Каждый цианид-ион предоставляет одну неподеленную электронную пару атома азота (НЭП) на свободные орбитали:
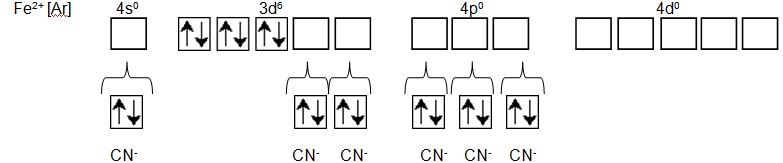
В результате этого образуются 6 донорно-акцепторных связей (ДА-связей).
4s-орбиталь; две 3d-орбитали и три 4р-орбитали гибридизуются. Таким образом, тип гибридизации - d2sp3. Геометрическая форма - правильный октаэдр.
Так как у катиона железа не имеется неспаренных электронов, следовательно, данный комплексный ион - диамагнитен.
Сообщение отредактировал plick - Пятница, 01.08.2014, 12:41 |
|
| |
| |
| |
| plick | Дата: Среда, 30.07.2014, 19:33 | Сообщение # 4 |

Группа: Супермодераторы
Сообщений: 876
| Задача 1.3.
Рассмотреть строение комплексных акваионов железа(III) и кобальта (III, определить тип гибридизации, геометрическую форму и магнитные свойства.
Аналогично задачам 1.2. и 1.3. записываем электронно-графические формулы атомов:


Составляем формулы соответствующих ионов:


Каждая молекула воды предоставляет одну НЭП атома кислорода на свободные орбитали. Но, в случае комплекса с железом, молекулы воды выступают в роли лигандов слабого поля, образуя внешнеорбитальный высокоспиновый комплекс:

В случае с катионом кобальта, молекулы воды проявляют свойства лиганда сильного поля, что связано с более стабильным состоянием Со3+ со спаренными электронами. В данном случае образуется низкоспиновый, внутриорбитальный комплекс:

Таким образом, в комплексном ионе [Fe(H2O)6]3+ наблюдается sp3d2 гибридизация, октаэдрическое строение и парамагнитные свойства.
В комплексном ионе гексааквакобальта(III) наблюдается d2sp3 гибридизация, октаэдрическое строение и диамагнитные свойства.
|
|
| |
| |
| |
| plick | Дата: Пятница, 01.08.2014, 12:39 | Сообщение # 5 |

Группа: Супермодераторы
Сообщений: 876
| Задача 1.4.
Рассмотреть строение комплексного диоксалатоникелат(II)-иона, определить тип гибридизации, геометрическую форму и магнитные свойства.
Формула комплексного иона запишется: [Ni(C2O4)2]2-
Электронно-графическая формула атома никеля записывается:

Электронно-графическая формула катиона никеля(II) записывается:

Оксалат-ион -ООС-СОО- (С2О42-) является бидентатным лигандом сильного поля, то есть вступает во взаимодействие с 3d-орбиталями, и образует 2 координационные хелатные связи: (Для наглядности образования хелата, оксалат-ион показан полностью)

Или схематически:

В итоге, катион никеля находится в состоянии dsp2 - гибридном состоянии, геометрическая фигура иона - плоский квадрат, ион диамагнитен.
Сообщение отредактировал plick - Пятница, 01.08.2014, 13:39 |
|
| |
| |
| |