|
вычисление ЭДС процесса
|
|
| Werossa | Дата: Вторник, 28.01.2014, 16:52 | Сообщение # 1 |

Группа: Пользователи
Сообщений: 282
| Добрый день, уважаемые химики! Рассматриваю процесс Bi(OH)3 + Na2SnO2 →
с целью вычисления константы равновесия.
Записала полное уравнение ОВР:
2 | Bi3+ + 3e– = Bi0 (окислитель, процесс восстановления) Е0ок
3 |SnO22- + 2ОН- - 2е– =SnO32- + H2O (восстановитель, процесс окисления) Е0восст
Общее число электронов, принимающих участие в реакции,равно 6.
Полное уравнение окислительно-восстановительной реакции:
3Na2SnO2 + 2 Bi(OH)3→ 2 Bi + 3 Na2SnO3 + 3H2O
да и ход решения мне понятен, но не могу найти справочное значение Е0 для полуреакции окисления:
Е0 восст.= Ео (SnO32-, H2O/ SnO22- , 2ОН-) = ...
Подскажите, пожалуйста, где посмотреть...Том №3 Справочника химика не помог, Лурье тоже...
Может, я неверно записала ОВР?
Сообщение отредактировал Werossa - Вторник, 28.01.2014, 16:53 |
|
|
Не стыдно не знать. Стыдно не хотеть знать. |
| |
| |
| FilIgor | Дата: Вторник, 28.01.2014, 17:06 | Сообщение # 2 |
 Эксперт
Группа: Супермодераторы
Сообщений: 6490
| У Лурье есть, просто там оно имеет несколько иной вид. Там гидроксокомплекс.
Тут у вас вот какая неточность - Вы пишете процесс для катиона Bi3+, а там же гидроксид, особенно если учесть, что реакция идет в щелочной среде.
|
|
|
It's futile to speculate about what might have been |
| |
| |
| Werossa | Дата: Вторник, 28.01.2014, 17:25 | Сообщение # 3 |

Группа: Пользователи
Сообщений: 282
| Цитата FilIgor (  ) У Лурье есть, просто там оно имеет несколько иной вид. Там гидроксокомплекс. Тут у вас вот какая неточность - Вы пишете процесс для катиона Bi3+, а там же гидроксид, особенно если учесть, что реакция идет в щелочной среде.
[Sn(OH)6]2- + 2e = [Sn(OH)6]4 Е0 = -0,93 В ???
А для висмута?
Буду признательна за помощь!
Сообщение отредактировал Werossa - Вторник, 28.01.2014, 17:30 |
|
|
Не стыдно не знать. Стыдно не хотеть знать. |
| |
| |
| FilIgor | Дата: Вторник, 28.01.2014, 17:39 | Сообщение # 4 |
 Эксперт
Группа: Супермодераторы
Сообщений: 6490
| Потенциал тот, реакция у Лурье записана иначе (по крайней мере, в моем издании).
Для висмута я бы записал так:
BiO(OH) + H2O + 3e = Bi + 3OH-
Е = - 0,46 В (Справочник по электрохимии).
|
|
|
It's futile to speculate about what might have been |
| |
| |
| Werossa | Дата: Вторник, 28.01.2014, 18:19 | Сообщение # 5 |

Группа: Пользователи
Сообщений: 282
| Цитата FilIgor (  ) Потенциал тот, реакция у Лурье записана иначе (по крайней мере, в моем издании).
А у Лурье действительно по-другому: Sn(OH)62- + 2e = HSnO2- + 3OH- + H2O (Е0 = -0,93 В )
Спасибо за консультацию, уважаемый FilIgor, буду разбираться дальше...
|
|
|
Не стыдно не знать. Стыдно не хотеть знать. |
| |
| |
| FilIgor | Дата: Вторник, 28.01.2014, 18:28 | Сообщение # 6 |
 Эксперт
Группа: Супермодераторы
Сообщений: 6490
| Цитата Werossa (  ) это информация с форума, раздел "Справочник по окислительно-восстановительным реакциям"
Я же не сказал, что реакция записана неправильно, я сказал - по-другому. Потенциал - тот же, это главное.
|
|
|
It's futile to speculate about what might have been |
| |
| |
| Werossa | Дата: Вторник, 28.01.2014, 18:35 | Сообщение # 7 |

Группа: Пользователи
Сообщений: 282
| Уважаемые химики! Посмотрите, пожалуйста, общее направление решения. Разбираю основы основ ОВР, но не всё получается самостоятельно, к сожалению...
Определить направление окислительно-восстановительной реакции взависимости от концентрации окислителей и восстановителей, присутствующих в
растворе, и от рН среды и записать уравнения реакций в ионной форме.
MnO4-+8H+ +5е → Mn2+ + 4H2O
SbO3- + H2O + 2e → SbO2- + 2OH-
а(MnO4-)=0,02, а(SbO3-)=1, рН=1. Активности всех остальных ионов приняты равными 1.
По условию задачи рН=1, следовательно [H+]=10-1М = 0,1 М
Если рН=1, то рОН=14-рН=14-1=13
Т.к. рОН = lg [OH-] , то [OH-] = 10-рОН = 10-13 моль/дм3
Запишем соответствующие полуреакции и значения их потенциалов:
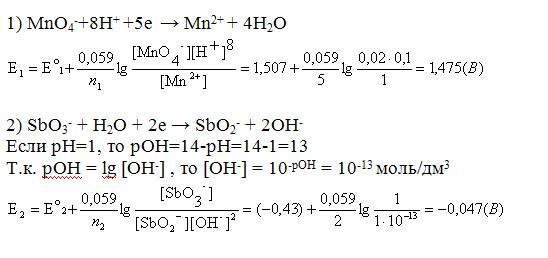
Найдем разность потенциалов:E=E01 -E02 = 1,475 – (0,047) = 1,522 (В).
Вывод: положительная разность потенциалов указывает на протекание реакции в направлении окисления иона SbO2- перманганат-ионом.
Уравнение ОВР:
2MnO4-+ 16H+ + 5SbO2- + 10OH- → 2Mn2+ + 8H2O + 5SbO3- + 5H2O
2КMnO4 + 5NaSbO2 + 6HCl → 2MnCl2 + 5NaSbO3+ 3H2O + 2KCl
Скажите, пожалуйста, не слишком экзотично получилось?
Сообщение отредактировал Werossa - Вторник, 28.01.2014, 18:37 |
|
|
Не стыдно не знать. Стыдно не хотеть знать. |
| |
| |
| FilIgor | Дата: Вторник, 28.01.2014, 19:16 | Сообщение # 8 |
 Эксперт
Группа: Супермодераторы
Сообщений: 6490
| 1. Реакция идет явно в кислой среде (что подтверждается рН). Поэтому такая запись, как
Цитата Werossa (  ) SbO3- + H2O + 2e → SbO2- + 2OH-
- не годится, там присутствует гидроксил, что в данном случае лишается смысла.
Я бы написал (на вскидку) примерно так:
SbO3- + 3H+ + 2e = HSbO2 + H2O
Соотв., потенциал будет иной.
2. В уравнении Нернста для перманганата [H+] возведен в 8 степень, в числовой части уравнения степень потеряна.
3. Уравнение, в принципе, в порядке, я бы, правда, в кислой среде написал бы сурьмянистые кислоты, напр. HSbO2. Но это не принципиально.
|
|
|
It's futile to speculate about what might have been |
| |
| |
| Werossa | Дата: Среда, 29.01.2014, 01:20 | Сообщение # 9 |

Группа: Пользователи
Сообщений: 282
| Цитата FilIgor (  ) не годится, там присутствует гидроксил, что в данном случае лишается смысла. Я бы написал (на вскидку) примерно так:
SbO3- + 3H+ + 2e = HSbO2 + H2O
Соотв., потенциал будет иной. Цитата FilIgor (  ) 2. В уравнении Нернста для перманганата [H+] возведен в 8 степень, в числовой части уравнения степень потеряна. 3. Уравнение, в принципе, в порядке, я бы, правда, в кислой среде написал бы сурьмянистые кислоты, напр. HSbO2. Но это не принципиально. |
|
|
Не стыдно не знать. Стыдно не хотеть знать. |
| |
| |