| Neitronik | Дата: Среда, 26.12.2012, 22:25 | Сообщение # 1 |
|
Группа: Пользователи
Сообщений: 12
| Надо выбрать анионный комплекс. Как это делается?
K2[Co(CNS)2Cl2]
[Ni(NH3)6]Cl3
|
|
| |
| |
| |
| FilIgor | Дата: Среда, 26.12.2012, 22:42 | Сообщение # 2 |
 Эксперт
Группа: Супермодераторы
Сообщений: 6490
| Очень просто это делается. Смотрите, у какого комплекса квадратная скобка имеет отрицательный заряд.
K2[Co(CNS)2Cl2]
[Co(CNS)2Cl2]2-
|
|
|
It's futile to speculate about what might have been |
| |
| |
| Neitronik | Дата: Среда, 26.12.2012, 23:24 | Сообщение # 3 |
|
Группа: Пользователи
Сообщений: 12
| Кошмар... А я всё это время думал, что внутри скобок надо что-то искать и высчитывать xD Здорово!
А называется он "ди_хлоро_ди_родано_кобальтат калия"? О_о
Заряд комплексообразователя (1+) и уравнение первичной диссоциации в растворе
K2[Co(CNS)2Cl2] = 2K+ + Co(CNS)22- + Cl2 , я правильно мыслю?
|
|
| |
| |
| |
| FilIgor | Дата: Среда, 26.12.2012, 23:36 | Сообщение # 4 |
 Эксперт
Группа: Супермодераторы
Сообщений: 6490
| Цитата (Neitronik) Кошмар... А я всё это время думал, что внутри скобок надо что-то искать и высчитывать
Вообще-то надо, да.
Цитата (Neitronik) А называется он "ди_хлоро_ди_родано_кобальтат калия
дихлордироданокобальтат (II) калия
Цитата (Neitronik) Заряд комплексообразователя (1+)
Вот тут как раз и надо высчитывать. Заряд комплексообразователя (+2)
Цитата (Neitronik) K2[Co(CNS)2Cl2] = 2K+ + Co(CNS)22- + Cl2 , я правильно мыслю?
Неправильно. Ну откуда там свободный хлор!
K2[Co(CNS)2Cl2] = [Co(CNS)2Cl2]2- + 2K+
|
|
|
It's futile to speculate about what might have been |
| |
| |
| Neitronik | Дата: Четверг, 27.12.2012, 00:10 | Сообщение # 5 |
|
Группа: Пользователи
Сообщений: 12
| А, то есть в этом соединении
K2[Co(CNS)2Cl2]
2(+) + [ (2+) + 2(-) + 2(-)] два атома хлора и два родано- лиганда разделяют электроны с кобальтом (комплексообразователем) и калием? И заряд кобальта равен +2...
А вот нашёл в инете: "Координационное число - число электронодонорных центров лигандов (атомов или p-связей), непосредственно взаимодействующих с комплексообразователем." То есть координационное число данного соединения равно двум? (два электрона нужны для связи с кобальтом, а другие два - с калием)
Пожалуйста, извините меня за бред, который я (наверняка) несу...
|
|
| |
| |
| |
| Сартул | Дата: Четверг, 27.12.2012, 00:31 | Сообщение # 6 |
|
Группа: Пользователи
Сообщений: 98
| В этом комплексе катион кобальта Co2+ образует четыре связи по донорно-акцепторному механизму с четырьмя лигандами.
Следовательно, КЧ центрального иона равно 4.
|
|
| |
| |
| |
| Neitronik | Дата: Пятница, 28.12.2012, 15:25 | Сообщение # 7 |
|
Группа: Пользователи
Сообщений: 12
| Спасибо Большое!
|
|
| |
| |
| |
| Werossa | Дата: Воскресенье, 16.02.2014, 09:55 | Сообщение # 8 |

Группа: Пользователи
Сообщений: 282
| Доброго времени суток, уважаемые химики-профессионалы! Пользуясь случаем, хочу выразить вам огромную благодарность за все пояснения и консультации, которыми этот замечательный сайт помогает жаждущим знаний людям. Ведь химия - наука увлекательная и творческая, однако непростая для самостоятельного изучения в одиночном плавании.
Посмотрите, пожалуйста, задачку. Я ее решила, но не уверена в правильности, поэтому обращаюсь к вам за профессиональным взглядом на мои попытки разобраться с химией комплексных соединений.
Запишите уравнение диссоциации комплексного иона [Zn(NH3)4]2+, выражение константы нестойкости 1/β,вычислите концентрацию иона комплексообразователя и концентрацию иона-осадителя, с помощью которого можно разрушить комплексный ион.
1/β=5,0*10-8
Ks(ZnS)=2,5*10-22
Решение
1) Уравнение диссоциации комплексного иона:[Zn(NH3)4]2+↔ Zn2++4NH30
2) Выразим константу нестойкости1/β данного комплексного иона:
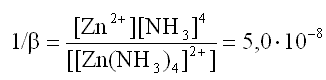
3) Вычислим концентрацию иона-комплексообразователя [Zn2+].
Обозначим [Zn2+]через х. При диссоциации 1 моль комплексного иона образуется х моль ионов Zn2+и 4*х моль молекул NH30. С учетом этого выражение для константы нестойкости комплексного иона можно переписать в виде:

В силу того, что в растворе слабого электролита концентрация ионов цинка [Zn2+]очень мала по сравнению с концентрацией комплексного иона, можно значение (1-х) приравнять к 1. Тогда получим:

Отсюда:

4) Реакция осаждения иона-комплексообразователя ионом-осадителем в труднорастворимый осадок:
Zn2+ +S2-→ZnS↓
Вычислим концентрацию иона-осадителя, с помощью которого можно разрушить комплексный ион [Zn(NH3)4]2+.
Если к раствору данного комплекса постепенно добавлять ион-осадитель, то разрушение комплекса начнется с того момента, когда концентрация сульфид-ионов [S2-] станет такой, какая вытекает из произведения растворимости осадка:
Кs(ZnS) = [Zn2+]*[S2-]
Учитывая, что [Zn2+]=1,99*10-2 моль/дм3,
[S2-] = Кs(ZnS) / [Zn2+] = 2,5*10-22 / 1,99*10-2= 1,26*10-20 моль/дм3.
Такая низкая концентрация иона-осадителя указывает на то, что образование осадка и разрушение комплекса начнется практически сразу, как только в раствор стали добавлять ионы S2-.
Постаралась максимально подробно написать решение, чтобы в случае ошибки можно было понять, где именно она зародилась...
Заранее ОЧЕНЬ признательна за уделенное моему вопросу время!!!
Сообщение отредактировал Werossa - Воскресенье, 16.02.2014, 10:08 |
|
|
Не стыдно не знать. Стыдно не хотеть знать. |
| |
| |
| plick | Дата: Воскресенье, 16.02.2014, 11:04 | Сообщение # 9 |

Группа: Супермодераторы
Сообщений: 876
| Цитата Werossa (  ) чтобы в случае ошибки можно было понять, где именно она зародилась...
Для начала в арифметике.
Вот вы скажите, как давно (4х)4 = 16х4???? Вернее даже так, как давно 44 = 16?
А все рассуждения абсолютно верны. Осталось пересчитать математику.
|
|
| |
| |
| |
| Werossa | Дата: Воскресенье, 16.02.2014, 12:04 | Сообщение # 10 |

Группа: Пользователи
Сообщений: 282
| Цитата plick (  ) Вот вы скажите, как давно (4х)4 = 16х4???? Вернее даже так, как давно 44 = 16?
Цитата plick (  ) А все рассуждения абсолютно верны. Осталось пересчитать математику.
Сообщение отредактировал Werossa - Воскресенье, 16.02.2014, 12:24 |
|
|
Не стыдно не знать. Стыдно не хотеть знать. |
| |
| |