|
Вопросы по химии
|
|
| денис1 | Дата: Пятница, 25.04.2014, 21:01 | Сообщение # 316 |

Группа: Пользователи
Сообщений: 1146
| Цитата lascheggia (  ) но в целях безопасности |
|
|
Е.В.Базаров: "Порядочный химик в двадцать раз полезнее всякого поэта". |
| |
| |
| Ефим | Дата: Пятница, 25.04.2014, 21:02 | Сообщение # 317 |

Группа: Супермодераторы
Сообщений: 1839
| Цитата денис1 (  ) 1)из бутандиола-1,3 получают бутадиен-1,3 дегидратацией. Почему дегидратация идёт против правила Зайцева? Имхо, должен получиться бутадиен-1,2.
Правило Зайцева касается только образования алкенов. Вообще это правило - далеко не абсолют. Есть правило Гофмана - оно гласит прямо противоположное. И все они выполняются только в достаточно простых случаях.
В данном случае условия дегидратации благоприятствуют образованию наиболее термодинамически устойчивого продукта. Даже если в процессе реакции получится аллен, он "разгруппируется" в сопряжённый бутадиен.
Цитата денис1 (  ) 2)Как можно получить этилен из метана? Имхо, две стадии:
1-CH4--1500°-->C2H2+H2
2-C2H2+H2--t,Pd-->C2H4
Может есть способ в одну стадию?
Может и есть. Я как-то не интересовался этим вопросом. 
Цитата денис1 (  ) 3)Какой галогенирующий агент сильнее? Тионилхлорид, хлорид фосфора(|||)или хлорид фосфора(V) ?
В одном справочнике написано, что хлорид фосфора(V) превращает карбоновые кислоты в геминальные трихлоралканы, а хлорид фосфора(|||) -в галогенангидриды, сам превращаясь в H3PO3. В другом написано,что и тот, и тот превращают в галогенангидриды. И в обоих написано, что тионилхлорид-только в галогенангидриды. Кому верить?
Я бы так поставил:
SOCl2 < PCl3 < PCl5
Гем-трихлоралкан из карбоновой кислоты может получиться - в достаточно жёстких условиях и с избытком PCl5. Но это не препаративная реакция, на практике не используемая, так как в жестких условиях PCl5 проявляет заметное хлорирующее действие, отщепляя хлор.
В обычных условиях все они работают только до хлорангидрида.
Цитата денис1 (  ) 4) омыление и гидролиз-полные синонимы?
"Омыление" обычно относится к гидролизу сложных эфиров, т.е. это более узкий термин, к тому же - устаревший.
Цитата денис1 (  ) 5) придумал цепочку. Прошу проверить. Нужно из метана получить лимонную кислоту.
CH4--1500°-->C2H2+H2
C2H2+H2O--Hg2+,t-->CH3CHO--[О ]-->CH3COOH--Cl2,P красный(пойдёт ли дальше галогенирование и как его контролировать?)-->CH2Cl-COOH--NaOH,t-->CH2OH-COONa--(какой окислитель здесь подойдёт?)-->CHO-COONa
CH2Cl-COOH--PCl3-->CH2Cl-COCl
CH3CHO--[H]-->C2H5OH
CH2Cl-COCl+ C2H5OH-->CH2Cl-COOC2H5+HCl
CH2Cl-COOC2H5+Mg--эфир-->C2H5OOC-CH2MgCl
NaOOC-CHO(может надо было сложный эфир вместо соли?)+ C2H5OOC-CH2MgCl---->гидролиз---->NaOOC-CHOH-CH2COONa--> NaOOC-CO-CH2COONa+ C2H5OOC-CH2MgCl--(c последующим гидролизом)(может опять надо было сложный эфир брать?)--->NaOOC-CH2-C(OH)COONa-CH2
COONa, затем добавляем сильную кислоту и получаем лимонную кислоту.
При хлорировании уксусной кислоты по Фольгарду-Зелинскому дихлоруксусная кислота - обычная и неизбежная примесь.
Гликолевая кислота (HO-CH2-COOH) окисляется в глиоксиловую (CHO-COOH) азотной кислотой в среде соляной кислоты в присутствии пятиокиси ванадия с выходом 70%
А вот получить реактив Гриньяра из хлорацетата невозможно. Реактивы Гриньяра реагируют со сложными эфирами! Тут надо использовать реакцию Реформатского (вместо магния брать цинк). И в качестве карбонильного субстрата использовать сложный эфир, а не соль.
С такой поправкой схема имеет право на существование. Хотя м кажется несколько громоздкой 
Сообщение отредактировал Ефим - Пятница, 25.04.2014, 21:03 |
|
| |
| |
| |
| lascheggia | Дата: Пятница, 25.04.2014, 21:02 | Сообщение # 318 |

Группа: Администраторы
Сообщений: 4239
| Цитата FilIgor (  ) Я весь изматерился, когда в сборнике типовых задач писал примеры с константами.
Мне тоже поматериться пришлось, изрядно.
Увы, порой действительно благими намерениями вымощена дорога в ад...
Практически все движки форумов рассчитаны на, грубо говоря, чистый текст и для формульного описания как таковые не предназначены. Соответственно, некие сочетания символов, широко применяемые в химии разработчиками не учитываются, что и приводит к подобным казусам. С одной стороны - удобство, ибо если пользователь напортачит с кодами, его система автоматически поправит, а с другой - нам, химикам, редкий, но головняк.
|
|
| |
| |
| |
| lascheggia | Дата: Пятница, 25.04.2014, 21:05 | Сообщение # 319 |

Группа: Администраторы
Сообщений: 4239
| Цитата денис1 (  ) они опасны?
Да, с их помощью можно вписать вредоносный код.
|
|
| |
| |
| |
| FilIgor | Дата: Пятница, 25.04.2014, 21:17 | Сообщение # 320 |
 Эксперт
Группа: Супермодераторы
Сообщений: 6490
| Цитата lascheggia (  ) редкий, но головняк.
Редко, но метко.
|
|
|
It's futile to speculate about what might have been |
| |
| |
| денис1 | Дата: Суббота, 26.04.2014, 18:15 | Сообщение # 321 |

Группа: Пользователи
Сообщений: 1146
| Цитата Ефим (  ) он "разгруппируется" в сопряжённый бутадиен.
Цитата Ефим (  ) SOCl2 < PCl3 < PCl5
Цитата Ефим (  ) не препаративная реакция Цитата Ефим (  ) азотной кислотой в среде соляной кислоты в присутствии пятиокиси ванадия с выходом 70% Цитата Ефим (  ) реагируют со сложными эфирами Цитата lascheggia (  ) вредоносный код. |
|
|
Е.В.Базаров: "Порядочный химик в двадцать раз полезнее всякого поэта". |
| |
| |
| денис1 | Дата: Суббота, 26.04.2014, 18:28 | Сообщение # 322 |

Группа: Пользователи
Сообщений: 1146
| Изменил цепочку.
CH4--1500°-->C2H2+H2
C2H2+H2O--Hg2+,t-->CH3CHO--[О ]-->CH3COOH--Cl2,P красный-->CH2Cl-COOH--NaOH,t-->CH2OH-COONa---->CHO-COONa
CH2Cl-COOH--PCl3-->CH2Cl-COCl
CH3CHO--[H ]-->C2H5OH
CH2Cl-COCl+ C2H5OH-->CH2Cl-COOC2H5+HCl
CH3COOH+NH3--t,через аммониевую соль-->CH3CONH2--P2O5,t-->CH3CN--Br2(вот здесь сомневаюсь. Пойдёт? И какие условия?)-->CH2Br-CN--Mg,эфир-->NC-CH2MgBr
NaOOC-CHO+ NC-CH2MgBr-->NaOOC-CH(OMgBr)-CH2CN--NaOH,t-->NaOOC-CHOH-CH2COONa--(какой окислитель брать?)-->NaOOC-CO-CH2-COONa--C2H5OH,H2SO4,t-->C2H5OOC-CO-CH2-COOC2H5
C2H5OOC-CO-CH2-COOC2H5+ClCH2-COOC2H5--Zn,t-->этилцитрат---гидролиз-->лим.к-та
Проверьте, пожалуйста. ~20 стадий получается 
|
|
|
Е.В.Базаров: "Порядочный химик в двадцать раз полезнее всякого поэта". |
| |
| |
| lascheggia | Дата: Суббота, 26.04.2014, 18:41 | Сообщение # 323 |

Группа: Администраторы
Сообщений: 4239
| Цитата денис1 (  ) и это повлияет на работу сайта или заразит компьютеры пользователей?
Второе в тех или иных вариантах.
|
|
| |
| |
| |
| денис1 | Дата: Суббота, 26.04.2014, 18:42 | Сообщение # 324 |

Группа: Пользователи
Сообщений: 1146
| Цитата lascheggia (  ) Второе в тех или иных вариантах. |
|
|
Е.В.Базаров: "Порядочный химик в двадцать раз полезнее всякого поэта". |
| |
| |
| Ефим | Дата: Суббота, 26.04.2014, 20:38 | Сообщение # 325 |

Группа: Супермодераторы
Сообщений: 1839
| Цитата lascheggia (  ) Я бы так поставил: SOCl2 < PCl3 < PCl5 Цитата денис1 (  ) неожиданно. Я наоборот думал, что PCl5 сильнее.
В смысле - "неожиданно"? Там, вообще-то ряд по возрастанию, то есть PCl5 и есть сильнее
Цитата денис1 (  ) что это значит?
"Не препаративная" - значит, не используется для целенаправленного синтеза.
Цитата денис1 (  ) Вы это наизусть помните?
Вспомнилась фраза из резюме (с баша):
"При наличии гугля - богоподобен"
Настоящий химик должен три вещи уметь:
- мыть пробирки пальцем
- в любой реакции заменить этанол изопропанолом
- задать правильный вопрос гуглю

Цитата денис1 (  ) А с карбоновыми кислотами? там ведь тоже карбонильная группа есть. А с их солями? С солями, имхо, точно не будет, т.к. там карбоксилат-анион, а не карбонильная группа.
Карбоновая кислота тупо развалит реактив Гриньяра, а солями он не реагирует.
|
|
| |
| |
| |
| Ефим | Дата: Суббота, 26.04.2014, 20:44 | Сообщение # 326 |

Группа: Супермодераторы
Сообщений: 1839
| Цитата денис1 (  ) CH3COOH+NH3--t,через аммониевую соль-->CH3CONH2--P2O5,t-->CH3CN--Br2(вот здесь сомневаюсь. Пойдёт? И какие условия?)-->CH2Br-CN--Mg,эфир-->NC-CH2MgBr
Правильно сомневаетесь. Я пытался получить бромацетонитрил таким образом - не получается (пришлось в обход делать). Но это ерунда по сравнению с тем, что реактив Гриньяра из бромацетонитрила, опять-таки, получить невозможно! Гриньяр с нитрилами на ура реагирует. Так что, цепочка, увы - опять обрывается 
Сообщение отредактировал Ефим - Суббота, 26.04.2014, 20:45 |
|
| |
| |
| |
| денис1 | Дата: Суббота, 26.04.2014, 21:12 | Сообщение # 327 |

Группа: Пользователи
Сообщений: 1146
| Цитата Ефим (  ) мыть пробирки пальцем  неужели больше мыть химику нечем? неужели больше мыть химику нечем?  
Цитата Ефим (  ) Гриньяр с нитрилами на ура реагирует.
И со сложными эфирами тоже интересно знать, как реакция идёт
нашёл файл
реакция №6,7 от верхней вертикальной по часовой стрелке объясните пожалуйста механизм
|
|
|
Е.В.Базаров: "Порядочный химик в двадцать раз полезнее всякого поэта". |
| |
| |
| Ефим | Дата: Суббота, 26.04.2014, 21:51 | Сообщение # 328 |

Группа: Супермодераторы
Сообщений: 1839
| Цитата денис1 (  ) как именно? что получается? И со сложными эфирами тоже интересно знать, как реакция идёт
С нитрилами - кетоны, со сложными эфирами - третичные спирты:
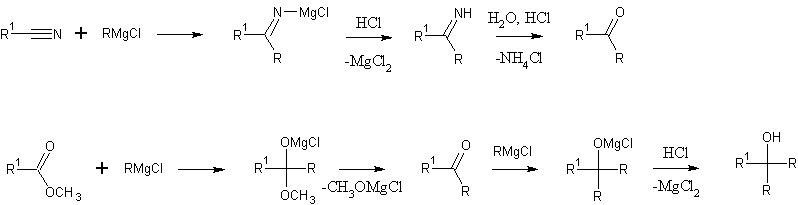
Цитата денис1 (  ) реакция №6,7 от верхней вертикальной по часовой стрелке объясните пожалуйста механизм
Механизм абсолютно одинаков в обоих случаях, вот только зачем в 7-й нарисовали гидроксиламид - бог весть. С амидами эта реакция точно так же идёт. Получаются альдегиды или кетоны:
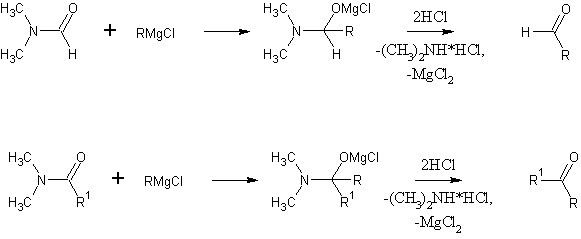
Сообщение отредактировал Ефим - Суббота, 26.04.2014, 21:55 |
|
| |
| |
| |
| денис1 | Дата: Воскресенье, 27.04.2014, 18:15 | Сообщение # 329 |

Группа: Пользователи
Сообщений: 1146
| Спасибо!
Изменил цепочку.
СH4--1500°-->C2H2--H2O,Hg2+,H+-->CH3CHO--[окислитель]-->CH3COOH--P,Cl2-->CH2Cl-COOH--NaOH-->CH2Cl-COONa--Mg,эфир-->NaOOC-CH2MgCl(вот здесь сомневаюсь, но Вы же сказали, что с солями они не реагируют)
СH3CHO--[H ]->C2H5OH
CH2Cl-COOH--NaOH,t-->CH2OH-COOH---->CHO-COOH--NH2OH-->HON=CH-COOH--C2H5OH,H+,t-->HON=CH-COOC2H5
HON=CH-COOC2H5+2NaOOC-CH2MgCl---->HO-N=CH-C(OH)(CH2COONa)2---NaOH,t-->NaOOC-CH2-C(OH)(CHO)-CH2-COONa--[окислитель]--> NaOOC-CH2-C(OH)(COOH)-CH2-COONa---H+-->лимонная кислота
Простите, на индексы времени нет.
Сообщение отредактировал денис1 - Воскресенье, 27.04.2014, 18:17 |
|
|
Е.В.Базаров: "Порядочный химик в двадцать раз полезнее всякого поэта". |
| |
| |
| Ефим | Дата: Воскресенье, 27.04.2014, 18:56 | Сообщение # 330 |

Группа: Супермодераторы
Сообщений: 1839
| Цитата денис1 (  ) CH2Cl-COONa--Mg,эфир-->NaOOC-CH2MgCl(вот здесь сомневаюсь, но Вы же сказали, что с солями они не реагируют)
Тут другая проблема будет: и хлорацетат, и гипотетический гриньяр из него нерастворимы в эфире. Практически этот процесс неосуществим.
Цитата денис1 (  ) HON=CH-COOH--C2H5OH,H+,t-->HON=CH-COOC2H5 HON=CH-COOC2H5+2NaOOC-CH2MgCl---->HO-N=CH-C(OH)(CH2COONa)2
Получение оксима, как я понял - попытка защитить карбонильную группу? Попытка неудачная, оксим с гриньяром ничуть не хуже реагирует. Альдегидный карбонил можно защитить, превратив его в ацеталь, например этиленгликолем. Защита снимается кислотным гидролизом.
|
|
| |
| |
| |