|
Вопросы по химии
|
|
| Ефим | Дата: Четверг, 29.09.2016, 19:25 | Сообщение # 796 |

Группа: Супермодераторы
Сообщений: 1839
| Цитата денис1 (  ) HCl, например, не является акцептором электронной пары, а лишь донором протона, который может быть акцептором электронной пары, т.е. кислотой Льюиса, но не сама молекула
Это верно. Речь может идти только о протоне.
Цитата FilIgor (  ) Да как сказать, не сама молекула. А гидрохлориды? Огромный спектр соединений типа R-NH2*HCl.
Гидрохлориды - таки ионные кристаллы. [R-NH3]+Cl-
В растворителях, не способствующих диссоциации, HCl - вообще не кислота. Например, 40%-й раствор HCl в сухом трет-бутаноле стабилен в течении нескольких суток. Добавка воды к такому раствору приводит к практически мгновенной реакции.
В сухом трет-бутаноле HCl практически не диссоциирует, находясь в виде сольватов с водородной связью. А вот при добавлении достаточного количества воды, появляются протоны, которые и выполняют свою работу.
То есть, молекула HCl не является кислотой ни в каком смысле, а вот при диссоциации возникает протон, являющийся кислотой Льюиса. А HCl, соответственно - становится кислотой Брёнстеда, поскольку получает способность отщеплять протон.
Ну, или - иными словами, протон - кислота Льюиса, это его имманентное свойство. Молекула, способная отщеплять протон - кислота Брёнстеда, но это свойство проявляется в зависимости от условий (в частности - от растворителя).
|
|
| |
| |
| |
| денис1 | Дата: Вторник, 11.10.2016, 00:23 | Сообщение # 797 |

Группа: Пользователи
Сообщений: 1146
| Спасибо!
Новый вопрос возник.
Мне совершенно не понятно, почему вообще образуются осадки. Ответ "это энергетически выгодно" меня не устраивает, так как он слишком общий. Хотелось бы знать какой-нибудь более частный ответ, содержащий механизм этого процесса. Например, в растворе содержатся ионы Ag+ и Cl-. Произведение их молярных концентраций многократно превышает ПР, следовательно, должен выпасть осадок. Казалось бы, логично предположить, что тут просто электромагнитное взаимодействие двух противоположно заряженных объектов. Они будут соединяться, чтобы уменьшить потенциальную энергию системы. Однако, если произведение их молярных концентраций не превышает ПР, то они останутся в растворе, хотя кулоновское взаимодействие также останется (да, там будет динамическое равновесие, но всё равно не почти все же будут соединяться в кристалл - сколько будет выпадать в осадок, столько будет и растворяться). Это рушит гипотезу. Получается, что ионы каким-то образом узнают о присутствии других ионов в растворе (прямо какой-то нелокальный процесс получается). Прошу помочь разобраться в вопросе.
|
|
|
Е.В.Базаров: "Порядочный химик в двадцать раз полезнее всякого поэта". |
| |
| |
| Ефим | Дата: Вторник, 11.10.2016, 19:22 | Сообщение # 798 |

Группа: Супермодераторы
Сообщений: 1839
| Цитата денис1 (  ) Мне совершенно не понятно, почему вообще образуются осадки. Ответ "это энергетически выгодно" меня не устраивает, так как он слишком общий. Хотелось бы знать какой-нибудь более частный ответ, содержащий механизм этого процесса. Например, в растворе содержатся ионы Ag+ и Cl-. Произведение их молярных концентраций многократно превышает ПР, следовательно, должен выпасть осадок. Казалось бы, логично предположить, что тут просто электромагнитное взаимодействие двух противоположно заряженных объектов. Они будут соединяться, чтобы уменьшить потенциальную энергию системы. Однако, если произведение их молярных концентраций не превышает ПР, то они останутся в растворе, хотя кулоновское взаимодействие также останется (да, там будет динамическое равновесие, но всё равно не почти все же будут соединяться в кристалл - сколько будет выпадать в осадок, столько будет и растворяться). Это рушит гипотезу. Получается, что ионы каким-то образом узнают о присутствии других ионов в растворе (прямо какой-то нелокальный процесс получается). Прошу помочь разобраться в вопросе.
"Нелокальный процесс" - это сильно сказано. Осталось вспомнить умозрительные построения Эйнштейна о "свободе воли электрона", когда он пытался обрушить квантовую теорию 
У Некрасова в его монографии мне врезался в память пассаж о растворимости сульфида ртути. Потенциометрические данный дают для ПР HgS совершенно фантастическую величину растворимости - 1 (одна) молекула на 159 литров воды. Некрасов назвал эту величину "лишённой физического смысла", но от обсуждения вопроса ушёл.
Выпадение осадка происходит не всегда. Пересыщенные растворы - реальность. И рассматривать равновесие надо в системе "раствор - кристалл", то есть - когда осадок уже есть. Если осадка нет - нет равновесия, и это положение может существовать сколь угодно долго. Ионы не знают о том, что их концентрация уже не равновесная, и пока нет второй фазы и поверхности раздела , об этом вообще никто не знает, даже господь бог.
Сообщение отредактировал Ефим - Вторник, 11.10.2016, 19:24 |
|
| |
| |
| |
| FilIgor | Дата: Вторник, 11.10.2016, 20:26 | Сообщение # 799 |
 Эксперт
Группа: Супермодераторы
Сообщений: 6490
| Цитата денис1 (  ) Ответ "это энергетически выгодно" меня не устраивает,
Хм, не устраивает... тем не менее, это ответ. При образовании кристаллического зародыша, находящегося в равновесии с жидкой фазой, он должен, по Гиббсу, иметь минимум свободной поверхностной энергии. Скорость возникновения устойчивых зародышей J пропорциональна вероятности их появления, сама же вероятность определяется работой, которую надо затратить на создание зародышей.
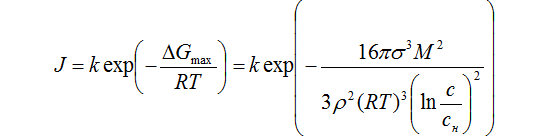
Цитата денис1 (  ) там будет динамическое равновесие, но всё равно не почти все же будут соединяться в кристалл
Вовсе нет. Кристалл - это уже кристалл, выраженная гетерогенная система с четкой границей раздела фаз, а между тем, равновесие там наблюдается на уровне зародышеобразования. У зародыша совсем иная поверхностная энергия.
Цитата денис1 (  ) Получается, что ионы каким-то образом узнают о присутствии других ионов в растворе
Каким-то... сталкиваются да и узнают. Ба! Хлор батькович, ты! А ведь тебя-то я и искал! Цепляйся, выпадать пора, обед уже.
Цитата Ефим (  ) но от обсуждения вопроса ушёл.
Теория растворов - одна из глобальных проблем современной химии.
|
|
|
It's futile to speculate about what might have been |
| |
| |
| Brooklyn | Дата: Среда, 19.10.2016, 11:45 | Сообщение # 800 |
|
Группа: Пользователи
Сообщений: 1
| Помогите пожалуйста! Необходимо ответить на вопрос. Напишите название по заместительной номенклатуре реагента, используемого в реакции алкилирования на последней стадии синтеза фентанила.
|
|
| |
| |
| |
| Ефим | Дата: Среда, 19.10.2016, 19:44 | Сообщение # 801 |

Группа: Супермодераторы
Сообщений: 1839
| Цитата Brooklyn (  ) Помогите пожалуйста! Необходимо ответить на вопрос. Напишите название по заместительной номенклатуре реагента, используемого в реакции алкилирования на последней стадии синтеза фентанила.
Ну так и нарисуйте схему реакции! Схемы могут быть разными - сиди, гадай...
Алкилировать там можно пиперидин по азоту. А алкилятором может быть, скажем, 1-бром-2-фенилэтан.
|
|
| |
| |
| |
| денис1 | Дата: Среда, 09.11.2016, 02:16 | Сообщение # 802 |

Группа: Пользователи
Сообщений: 1146
| Спасибо!
Какой механизм у реакции образования йодоформа из ацетона в щелочной среде? Имеет ли какое-то значение таутомерия в данном процессе? Если нет (я думаю, что нет), то какие опыты можно провести на изомерию вообще, чтобы реактивы были доступные? Мне в голову приходит только ацетон и пропионовая кислота. Из них только кислота реагирует с щелочами.
Я бы, наверное, нашёл ответ, просто сейчас нет времени искать. Поэтому и спрашиваю.
|
|
|
Е.В.Базаров: "Порядочный химик в двадцать раз полезнее всякого поэта". |
| |
| |
| денис1 | Дата: Суббота, 19.11.2016, 16:05 | Сообщение # 803 |

Группа: Пользователи
Сообщений: 1146
| Ефим, FilIgor, lascheggia, помогите, пожалуйста.
|
|
|
Е.В.Базаров: "Порядочный химик в двадцать раз полезнее всякого поэта". |
| |
| |
| Ефим | Дата: Суббота, 19.11.2016, 17:12 | Сообщение # 804 |

Группа: Супермодераторы
Сообщений: 1839
| Цитата денис1 (  ) Какой механизм у реакции образования йодоформа из ацетона в щелочной среде? Имеет ли какое-то значение таутомерия в данном процессе? Если нет (я думаю, что нет), то какие опыты можно провести на изомерию вообще, чтобы реактивы были доступные? Мне в голову приходит только ацетон и пропионовая кислота. Из них только кислота реагирует с щелочами. Я бы, наверное, нашёл ответ, просто сейчас нет времени искать. Поэтому и спрашиваю.
Как раз таутомерия и играет основную роль.
Всё начинается с присоединения йода к енолу:
I2 + OH- ----> IOH + I-
CH3-C(OH)=CH2 --(IOH)--> CH3-C(OH)2-CH2I --(-H2O)--> CH3-CO-CH2I
Дальше енолизация только ускоряется, пока до трийодацетона дело не дойдёт, а уж он в щелочной среде расщепляется на йодоформ и ацетат.
Далее вопрос становится совсем непонятным
- что такое "опыты на изомерию"?
- при чём тут пропионовая кислота, реагирующая со щелочами?
- почему нет времени искать? Если вас удерживают в заложниках - скажите "нет" и сохраняйте спокойствие, помощь близка.
Сообщение отредактировал Ефим - Суббота, 19.11.2016, 17:19 |
|
| |
| |
| |
| денис1 | Дата: Суббота, 19.11.2016, 21:22 | Сообщение # 805 |

Группа: Пользователи
Сообщений: 1146
| Цитата Ефим (  ) Дальше енолизация только ускоряется Цитата Ефим (  ) расщепляется на йодоформ и ацетат. Цитата Ефим (  ) Далее вопрос становится совсем непонятным
Цитата Ефим (  ) что такое "опыты на изомерию"? Цитата Ефим (  ) при чём тут пропионовая кислота, реагирующая со щелочами? Цитата Ефим (  ) почему нет времени искать? |
|
|
Е.В.Базаров: "Порядочный химик в двадцать раз полезнее всякого поэта". |
| |
| |
| Ефим | Дата: Воскресенье, 20.11.2016, 00:31 | Сообщение # 806 |

Группа: Супермодераторы
Сообщений: 1839
| Цитата денис1 (  ) То есть иодацетон и дииодацетон будут легче енолизироваться (или енолизоваться - как правильно?)? А возможно ли образование тетра, пента и гексаиодпроизводных, если реакция продожится по тому же механизму, только вместо метила будет трииодметил?
Да, они будут быстрее енолизироваться (или енолизоваться - тут уж русский язык простор даёт).
Реакция с другой стороны кетона не пойдёт в заметной степени именно потому, что идёт ускорение енолизации там, где йод уже имеется. А трийодацетон расщепляется моментально.
Цитата денис1 (  ) А какой там механизм реакции будет?
СI3-CO-CH3 + OH- ----> [CI3- + HOC(=O)-CH3] ----> CI3H + CH3COO-
Обычное нуклеофильное замещение
|
|
| |
| |
| |
| денис1 | Дата: Суббота, 15.04.2017, 20:33 | Сообщение # 807 |

Группа: Пользователи
Сообщений: 1146
| Ефим, спасибо!
У меня есть новый вопрос. Представим, что у нас есть жидкость с температурой, равной температуре кипения, находящаяся под некоторым давлением. Затем мы переводим жидкость в состояние пара при температуре кипения. Давление остаётся неизменным. Я думаю, что внутренняя энергия системы увеличится на значение теплоты, сообщённое системе (эта теплота будет равна произведению удельной теплоты парообразования на массу жидкости). А авторы одного задачника считают, что увеличение внутренней энергии будет меньше на величину, равную работе изобарного расширения пара (которая равна pV (пара в конце кипения)). Скажите, пожалуйста, кто прав.
|
|
|
Е.В.Базаров: "Порядочный химик в двадцать раз полезнее всякого поэта". |
| |
| |
| FilIgor | Дата: Суббота, 15.04.2017, 21:08 | Сообщение # 808 |
 Эксперт
Группа: Супермодераторы
Сообщений: 6490
| Если давление остается неизменным, это может для данных условий означать только то, что система расширяется. Ну а раз она расширяется - газ совершает работу расширения, т.е. авторы правы, конечно. Ну а иначе как Вы совместите несовместимое - испарение жидкости и одновременно постоянные давление и объем?
Но Вы с авторами не вступаете в противоречие, на самом деле. Энергия системы увеличится на подведенную энергию испарения за вычетом энергии работы расширения, только и всего.
|
|
|
It's futile to speculate about what might have been |
| |
| |
| Mady_55 | Дата: Четверг, 20.04.2017, 11:34 | Сообщение # 809 |
|
Группа: Пользователи
Сообщений: 1
| Помогите решить задачки, пожалуйста!!!
1) Раствор H2SO4 для создания среды в титриметрии приготовили
сливая остатки 3х растворов 50, 5,25 и 14,5 мл. с разными концентрациями.
Получите объем полученного раствора
2) Рассчитайте молярную и равновесную концентрации иона Ag+ в 0,01 М растворе AgNO3 в присутствии 2,0 М NH3
3) В каком объеме воды необходимо растворить 1,000 г. 17,58 % раствора HNO3. Ср=1,100 г/см3.
Чтобы pH полученного раствора был равен 1,5?
4) Рассчитайте Е0 NO2/N2 для полуреакции 2NO3 + 6H+ + 6e=N2O+3H2O
Исходя из величин Е0 HNO2/N2O=1.29 В и E N2O/HNO2=1.09В
|
|
| |
| |
| |
| FilIgor | Дата: Четверг, 20.04.2017, 21:01 | Сообщение # 810 |
 Эксперт
Группа: Супермодераторы
Сообщений: 6490
| Цитата Mady_55 (  ) Помогите решить задачки, пожалуйста!!!
Создаем тему в разделе "Консультации".
Не забываем прочесть правила названия тем.
|
|
|
It's futile to speculate about what might have been |
| |
| |